-
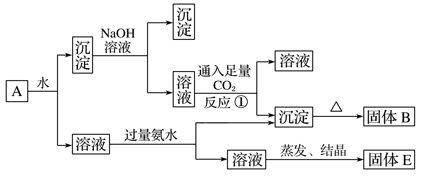
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH
、K+、CO
、SO
等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
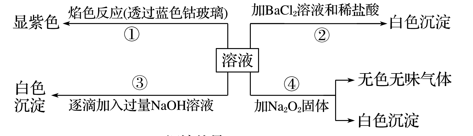
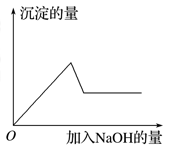
在第③个实验中,
生成白色沉淀的量与加入NaOH的量有右图所示的相互关系。据此可知:
(1)在原溶液中一定不存在的离子有_______________________________________________。
(2)为满足该溶液中一定存在的离子的要求,一般可溶解两种常见物质为(写化学式)________和____________。
(3)写出第③个实验中发生反应的离子方程式:_________________________________________。
难度: 中等查看答案及解析
-
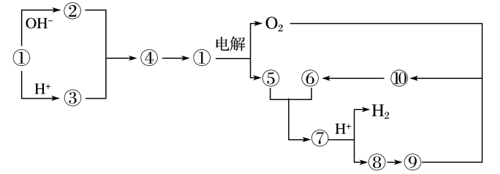
甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:

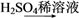
(1)若甲是CO2。
①常用于泡沫灭火器的是________(填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是__________。
(2)若甲是Al。
①Al的原子结构示意图为___________。
②当n(Al)∶n(NaOH)∶n(H2SO4)=1∶1∶2时,丙的化学式是__________。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是_________________________。
②常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka=____________(用含a的代数式表示)。
难度: 中等查看答案及解析
-
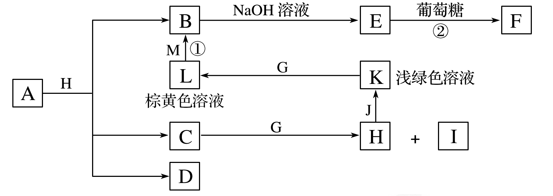
物质X是某新型净水剂的中间体,它可以看成由氯化铝(在180 ℃升华)和一种盐A按物质的量之比1∶2组成。在密闭容器中加热8.75 g X使之完全分解,冷却后可得到3.2 g固体氧化物B、0.448 L无色气体D(体积已折算为标准状况)、4.27 g混合晶体E。B溶于稀盐酸后,滴加KSCN溶液,混合液变血红色。D气体能使品红溶液褪色。请回答下列问题:
(1)X的化学式为_________。
(2)将A固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、D和另一种化合物,则A分解的化学方程式为_____________________________________________________。
(3)将E混合晶体溶于水配成溶液,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为________________________________。
E混合晶体中某种物质在一定条件下能和KI固体反应,写出该方程式:___________________。
(4)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,其分子式是________。请设计实验方案验证之____________________________________________________________。
难度: 简单查看答案及解析
-
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________;X与过量浓硝酸反应后溶液中含有的盐的化学式是________,检验该盐溶液中含有的阳离子的试剂为________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是__________(填字母)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
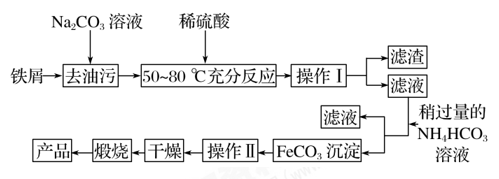
回答下
列问题:
①操作Ⅰ的名称是_________________,操作Ⅱ的名称是_________________;操作Ⅱ的方法为____________________________________________________________________________。
②Na2CO3溶液可以除油污,原因是_____________________ (用离子方程式表示)。
③请完成生成FeCO3沉淀的离子方程式:Fe2+ +2HCO
===FeCO3↓+ ________+H2O。
难度: 简单查看答案及解析