-
化学与生活息息相关,下列有关说法不正确的是
A.“雾霾天气…光化学烟雾”的形成都与汽车排放的不合格尾气有关
B.葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
C.“辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
D.页岩气是从页岩层中开采出来的天然气。产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,15 g甲基(-CH3)所含的电子数为7NA
B.水的摩尔质量就是NA个水分子的质量之和
C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L
D.1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子
难度: 中等查看答案及解析
-
相对分子质量为128的有机物A完全燃烧只生成CO2和H2O,若A含一个六碳环且可与NaHCO3溶液反应,则其环上一溴代物的数目为
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
用可再生的物质制备乙酸乙酯的绿色合成路线之一如下图所示:

下列说法正确的是
A.常温下,M能与银氨溶液发生反应
B.④的反应类型属于酯化反应,不属于取代反应
C.用饱和碳酸钾溶液能鉴别乙醇、乙酸和乙酸乙酯.
D.淀粉和纤维素的化学式均为( C6H10O5)n,二者互为同分异构体
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)
B.元素Z、W的简单离子的离子半径大小:W+> Z2-
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式.其中正确的是
A.向NaAlO2溶液中通入足量的CO2:A1O2-+CO2 +2H2O=A1(OH) 3 ↓+HCO3-
B.(NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4+ +Fe2+ +4OH-=Fe(OH) 2 ↓+2NH3·H2O
C.磁性氧化铁溶于稀硝酸:3Fe2+ +4H++NO3-=3Fe3+ +NO↑+3H2O
D.工业上用氨水吸收二氧化硫:2OH-+SO2=SO32-+H2O
难度: 中等查看答案及解析
-
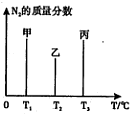
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。

已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是
A.MgCO3、CaCO3、MnCO3的KSP依次增大
B.a点可表示 MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-)
难度: 中等查看答案及解析
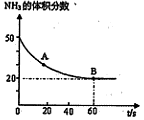


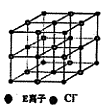
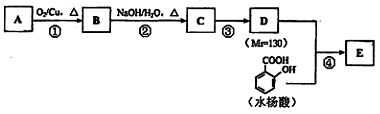
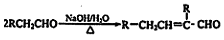 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下: