-
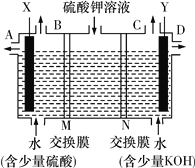
乙烷中混有少量乙烯气体,欲除去乙烯并得到纯净干燥的乙烷气体,选用的试剂最好是
A. 氢氧化钠溶液,浓硫酸
B. 酸性高锰酸钾溶液,浓硫酸
C. 溴水,浓硫酸
D. 饱和碳酸钠溶液,浓硫酸
难度: 简单查看答案及解析
-
下列说法正确的是
A. 需要加热才能发生的化学反应都是吸热反应
B. 应用盖斯定律可以计算某些难以测量的反应焓变
C. 任何能使熵值增大的过程都能自发进行
D. 化学平衡发生移动,平衡常数一定发生变化
难度: 简单查看答案及解析
-
下列有关石油的炼制工艺中,属于获得汽油的主要途径的是
A. 裂化 B. 裂解 C. 常压分馏 D. 减压分馏
难度: 简单查看答案及解析
-
可逆反应A(s)+B(g)
2C(g) ΔH<0,在密闭容器中达到平衡后,改变条件,能使B的转化率提高的是
A. 保持温度不变,增大容器体积使压强减小
B. 保持恒温恒容,充入氦气
C. 其他条件不变时,升高温度
D. 保持恒温恒容,加入一定量A物质
难度: 简单查看答案及解析
-
恒定温度下,反应CO(g)+2H2(g)
CH3OH(g)在一个体积可控的密闭容器中进行,达到平衡后,充入一定量H2,并适当增大容器体积使H2的浓度维持不变,则CO的转化率跟原平衡状态相比
A. 增大 B. 不变 C. 减小 D. 无法判断
难度: 中等查看答案及解析
-
下列热化学式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ·mol-1
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:
N2+3H2(g)
 2NH3(g); △H = -38.6 kJ·mol-1
2NH3(g); △H = -38.6 kJ·mol-1C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1); △H = -57.3 kJ·mol-1
D. 1molH2完全燃烧放热 142.9kJ ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1);△H =+285.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列离子在水溶液中能大量共存的是
选项
离子
A
K+、SO
、Cl-、HS-
B
Na+ 、Al3+ 、Cl- 、HCO
C
H+、Ba2+、NO
、CH3COO-
D
Fe2+、Na+、NO
、ClO-
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )
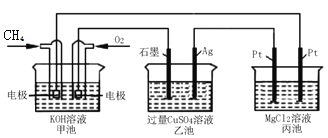
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池中正极的电极反应式是O2+4e-+4H+=2H2O
C. 反应过程中,乙池的pH逐渐减小
D. 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1∶2
难度: 困难查看答案及解析
-
分子式为C5H10的属于烯烃的同分异构体有多少种(不考虑顺反异构现象)
A. 4种 B. 5种 C. 6种 D. 7种
难度: 简单查看答案及解析
-
烯烃在一定条件下发生氧化反应时C===C键发生断裂, RCH===CHR′可以氧化成RCHO和R′CHO, 在该条件下,下列烯烃分别被氧化后产物可产生乙二醛的是
A. CH3CH===CH(CH2)2CH3 B. CH2===CH(CH2)2CH3
C. CH3CH===CH—CH===CHCH3 D. CH3CH2CH===CHCH2CH3
难度: 简单查看答案及解析
-
从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )
A.HR应为红色 B.HR应为蓝色
C.R-应为无色 D.R- 应为红色
难度: 中等查看答案及解析
-
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是

A. 放电时,电极A为负极,Na+由A极向B极移动
B. 该电池不能在常温下工作
C. 充电时,电极B连接外电源的负极
D. 放电时,B极的电极反应式为xS+2e-===S
难度: 中等查看答案及解析
-
已知25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11,下列说法正确的是
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体,c(Mg2+)不变
C. 25 ℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
D. 25 ℃时,在Mg(OH)2悬浊液中加入NaF固体,Mg(OH)2可能转化为MgF2
难度: 中等查看答案及解析
-
25 ℃时,将pH=2的强酸溶液与pH=13的强碱溶液混合,所得混合液的pH=11,则强酸溶液与强碱溶液的体积比是(忽略混合后溶液的体积变化)
A. 11∶1 B. 9∶1 C. 1∶11 D. 1∶9
难度: 困难查看答案及解析
-
常温下,将乙酸溶液与NaOH溶液混合,所得溶液的pH=7,则此溶液中
A. c(CH3COO-)>c(Na+)
B. c(CH3COO-)<c(Na+)
C. c(CH3COO-)=c(Na+)
D. 无法确定c(CH3COO-)与c(Na+)的大小关系
难度: 简单查看答案及解析
-
在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
难度: 中等查看答案及解析
-
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-18 kJ·mol-1
C. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1
难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:t ℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述不正确的是( )
A. 该反应的化学方程式是:CO(g)+H2O(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式:
 =
=,判断此时的温度是1000 ℃
难度: 中等查看答案及解析
-
一定条件下,碳素钢腐蚀与表面水膜pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO
下列说法不正确的是
A. 在pH<4的溶液中,主要发生析氢腐蚀
B. 在pH>6的溶液中,主要发生吸氧腐蚀
C. 在pH>14的溶液中,正极反应为O2+4OH-+4e-===2H2O
D. 在煮沸除氧气后的碱性溶液中,腐蚀速率会减慢
难度: 中等查看答案及解析