-
下列说法正确的是
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
难度: 简单查看答案及解析
-
CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法中正确的是
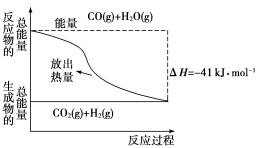
A.该反应为吸热反应
B.CO(g)和H2O(g)所具有的总能量小于CO2(g)和H2(g)所具有的总能量
C.反应的热化学方程式:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·mol-1
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和H2O(g)要吸收41 kJ的热量
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是
A.2 L 氟化氢气体分解成1 L 氢气与1 L 氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,断裂反应物分子中的化学键吸收的总能量小于形成生成物分子中的化学键放出的总能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
难度: 简单查看答案及解析
-
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+
O2(g)
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+
O2(g)
SO3(g) ΔH=-196.6 kJ·mol-1
难度: 简单查看答案及解析
-
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量高,由O2变为O3为放热反应
B.等质量的O2比O3能量低,由O2变为O3为吸热反应
C.O3比O2稳定,由O2变为O3为吸热反应
D.O2比O3稳定,由O2变为O3为放热反应
难度: 简单查看答案及解析
-
下列热化学方程式中ΔH的数值表示可燃物燃烧热的是
A.N2H4(g)+O2(g)===N2 (g)+ 2H2O(g) ΔH=-534.4 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.CO(g)+
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
难度: 简单查看答案及解析
-
对于反应A2(g)+ 3B2(g)
2C(g),以下表示其化学反应速率最快的是
A.v(A2) =0.4mol/(L•s) B.v(B2) =0.8mol/(L•s)
C.v(C) =0.6mol/(L•s) D.v(B2) =4.2mol/(L•min)
难度: 简单查看答案及解析
-
有关下图装置的说法中正确的是
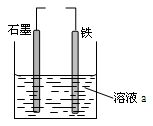
A.若两电极直接连接,a是食盐水,则发生析氢腐蚀
B.若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大
C.若两电极直接连接,则电子从铁流向石墨
D.若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动
难度: 简单查看答案及解析
-
可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaOH溶液为电解质溶液时,电池在工作过程中电解液的pH保持不变
B.以NaOH溶液为电解质溶液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为:O2+2H2O+4e-===4OH-
D.电池工作时,电子通过外电路从正极流向负极
难度: 中等查看答案及解析
-
在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列该电池的电极反应,正确的是
A.负极反应为Zn-2e-===Zn2+
B.负极反应为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应为2MnO2+2H2O+2e-===2MnOOH+2OH-
D.正极反应为2MnO2+2H++2e-===2MnOOH
难度: 简单查看答案及解析
-
在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g)
3Z(g)+2W(g),该X、Y的初始浓度分别为2.5 mol·L-1和2.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是
A.c(Z)=1.5 mol·L-1 B.c(Z)=2.4 mol·L-1
C.c(W)=1.6 mol·L-1 D.c(W)=2.0 mol·L-1
难度: 简单查看答案及解析
-
用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故需加NaOH固体才能恢复到原溶液
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
难度: 中等查看答案及解析
-
下列有关电化学的装置完全正确的是
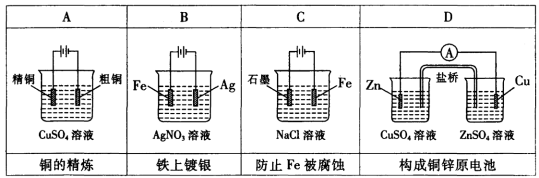
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是
A.化学反应速率是指单位时间内任何一种反应物物质的量的浓度的减少或任何一种生成物的物质的量的浓度的增加
B.化学反应速率为1.0 mol·L-1·s-1,是指在1 s时某物质的浓度是1.0 mol·L-1
C.化学反应速率可以衡量化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象不一定越明显
难度: 简单查看答案及解析
-
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
A.放电时PbO2是电池的负极
B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4
C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强
D.充电时,该电池的正极接电源的负极
难度: 简单查看答案及解析
-
下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 简单查看答案及解析
-
将Mg条投入盛有稀HCl的容器里,产生H2的速率与下列因素:
①盐酸浓度 ②温度 ③镁条的表面积 ④溶液中c(Cl-)大小,有关系的是
A.①② B.③④ C.①②③ D.①②③④
难度: 简单查看答案及解析
-
如下图所示,下列叙述正确的是
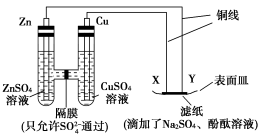
A.片刻后CuSO4溶液中的c(SO42—)增大
B.X为正极,发生氧化反应
C.Y与滤纸接触处变红
D.电流沿Cu
X
Y
Zn路径流动
难度: 中等查看答案及解析
-
相同条件下,下列各反应均为放热反应,其中△H值最小的是
A.2A(g) +B(g) ==2C(l) △H1
B.2A (g) +B(g) ==2C(g) △H2
C.2A (l)+B(l)==2C(g) △H3
D.2A (l) + B(l)==2C(l) △H4
难度: 简单查看答案及解析
-
下图中两电极上发生的电极反应如下:a极:2H++2e-===H2↑,b极:Cu-2e-== Cu 2+
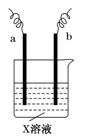
下列说法不正确的是
A.X溶液的pH增大
B.该装置可能是将化学能转化为电能
C.该装置一定是电解池
D.a和b可能是同种电极材料
难度: 中等查看答案及解析
-
对于一个恒容密闭容器中进行的可逆反应:mA(气)+nB(气)
eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每消耗m个A分子的同时也生成了d个D分子
C.单位时间内每生成e个C分子的同时也生成了n个B分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
难度: 简单查看答案及解析
-
相同材料的铁在图中的四种情况下最不易被腐蚀的是
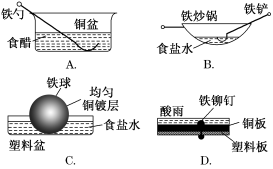
难度: 中等查看答案及解析
-
用铂电极电解100mL H2SO4 与CuSO4 的混合液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合液中Cu2+的物质的量浓度为
A.1mol/L B.2mol/L C.2.5mol/L D.3mol/L
难度: 中等查看答案及解析
-
(8分)在一定体积的密闭容器中,进行如下化学反应:
C(s)+ H2O (g)
CO(g)+ H2 (g),其化学平衡常数K和温度t的关系如下表:
完成下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)能判断该反应是否达到化学平衡状态的依据是__________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(H2)
(3)某温度下,平衡浓度符合下式:c(CO)·c(H2)= c(H2O),试判断此时的温度为___________℃;在此温度下,若反应开始时H2O (g)的浓度为a mol/L,当反应达到平衡时测得CO与H2的浓度均为0.2 mol/L,则反应开始时H2O的浓度a=_______ mol/L。
难度: 中等查看答案及解析
-
(17分)电化学原理在日常生活和工农业生产中发挥着重要作用。钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:

(1)写出石墨电极的电极反应_________________________;
(2)将该装置作简单修改即可成为钢铁电化学防护的装置,请在上图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向且完成以下问题
①简单修改后的该防护装置的名称为__________________________________
写出修改后石墨电极的电极反应式____________________________________;
②_______极(填“正极”“负极”“阳极”“阴极”)附近溶液的pH增大;
③检验阳极产物的方法是_____________________________________________;
④修改后的装置共收集到标准状况下的气体11.2 L时,则有______mol电子发生转移,假设溶液的体积为200ml,则此时溶液中OH-的物质的量浓度为________ mol/L
难度: 困难查看答案及解析