-
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与此理念相违背的是
A.在食品中大量添加苯甲酸钠等防腐剂,延长其保质期
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.加快高效洁净能源转换技术的开发,缓解能源危机
D.用“三层复合石头纸”替代木浆纸,减少树木砍伐
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.乙烯的结构简式:
B.中子数为20的钾原子:
C.次氯酸的电子式:
D.
分子的比例模型:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.
、
、
、
B.
的溶液:
、
、
、
C.
的溶液:
、
、
、
D.与铝反应产生大量氢气的溶液:
、
、
、
难度: 中等查看答案及解析
-
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是

A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=
难度: 中等查看答案及解析
-
下列有关物质的性质和应用不相对应的是
A.Na2O2能与CO2反应生成O2,可用于潜艇内供氧
B.C12能与水反应生成HC1O,可用于自来水的消毒
C.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹
D.N2与O2在放电时反应生成NO,此反应用于工业上制硝酸
难度: 中等查看答案及解析
-
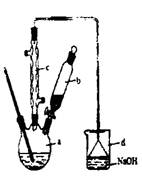
用下列实验装置进行相应实验,能达到实验目的是

A.用图1所示装置制取少量的氨气
B.用图2所示装置配制一定物质的量浓度的硫酸
C.用图3所示装置从食盐水中提取NaC1
D.用图4所示装置除去NO2中的NO
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①
②
③
④
⑤
A.①③ B.①④ C.②④ D.③⑤
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,31gNa2O中含有的离子总数为2NA
B.标准状况下,22.4LCC14中含有的分子数目为NA
C.标准状况下,2.24LCO2和SO2混合气体中含有的氧原子数目为0.2NA
D.常温常压下,0.1mo1C12溶于足量NaOH溶液中,转移的电子数目为0.2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.漂白粉溶液在空气中失效:
B.浓盐酸与MnO2反应制取氯气:
C.醋酸溶液与水垢中的Mg(OH)2反应:
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:
难度: 中等查看答案及解析
-
下列有关说法错误的是
A.NH3(g)+HC1(g)=NH4C1(S)低温下能自发进行,说明该反应的△H<O
B.为保护海轮的船壳,常在船壳上镶入锌块
C.纯碱溶于热水中,去污效果增强,说明纯碱的水解是吸热反应
D.反应N2(g)+3H2(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动。
难度: 中等查看答案及解析
-
NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如下图所示(未表示出其空间构型)。下列关于NM-3的性质描述正确的是
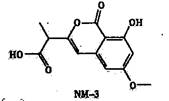
A.能发生加成、取代、消去反应
B.能使溴的四氯化碳溶液褪色
C.能与FeC13溶液发生显色反应
D.1mo1该物质最多可与2mo1NaOH反应
难度: 中等查看答案及解析
-
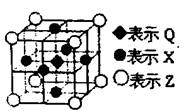
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向FeC12溶液中通入适量C12
溶液由浅绿
色变为黄色
C12的氧化性比FeC13的强
B
淀粉溶液在硫酸存在下水解一段时间后直接与银氨溶液混合
无银镜出现
淀粉没有水解
C
向澄清石灰水中通入某种气体
出现白色沉淀
该气体一定是CO2
D
BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸
有气体生成
难度: 中等查看答案及解析
-
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表
物质
A(g)
B(g)
C(g)
物质的量/mo1
1.2
0.6
0.6
下列说法正确的是
A.反应前20s的平均速率为
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
难度: 中等查看答案及解析
-
常温下,在
溶液中逐滴加入
溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是

A.在0.1mo1/L Na2CO3溶液中:
B.当溶液pH为7时,溶液的总体积为20mL
C.在B点所示的溶液中,阳离子浓度最大的是Na
D.在 A点所示的溶液中:
难度: 中等查看答案及解析
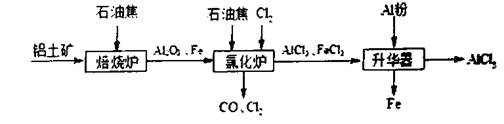


 是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以 和
和