-
将一定量的氯气通入60mL10mol/L.热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO 和NaClO3的共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3mol
B. 反应后的溶液中,n(Na+): n(Cl-)可能为7 :3
C. 该反应的氧化产物为NaClO3
D. n(NaCl):n(NaClO) :n(NaClO3)可能为11: 2: 1
难度: 困难查看答案及解析
-
《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法——“以火烧之,紫青烟起,乃真硝石也”。这是利用了
A. 升华 B. 氧化还原反应 C. 蒸馏 D. 焰色反应
难度: 简单查看答案及解析
-
若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数的值)
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下图虚线框中的装置(试剂均足量)可用来检验浓硫酸与木炭粉在加热条件下反应所产生的所有气体产物,下列说法正确的是
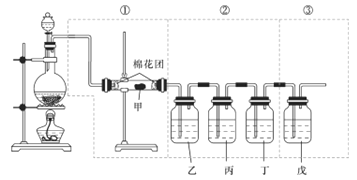
A. 物质甲可以是无水硫酸铜、变色硅胶、无水氯化钙等物质
B. 丙中发生反应的离子方程式可能是SO2+2OH-=SO32-+H2O
C. 乙和戊两种溶液都不宜用作尾气吸收装置中的试剂
D. 如果将装置的连接顺序变为①③②,则只能检验出两种产物
难度: 中等查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子。离子浓度均为0.3mol·L-1。某同学进行了如下实验:

下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
C. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
D. 无法确定沉淀C的成分
难度: 中等查看答案及解析
-
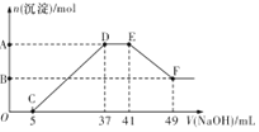
往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图像部分重叠)溶液中离子的对应关系,正确的是
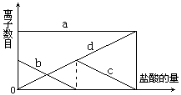
A.a:Cl- b:K+ c:CO32- d:HCO3-
B.a:K+ b:CO32- c:Cl- d:HCO3-
C.a:K+ b:CO32- c:HCO3- d:Cl-
D.a:K+ b:HCO3- c:Cl- d:CO32-
难度: 困难查看答案及解析
-
下列解释事实的离子方程式中,正确的是
A. 三氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B. “84”消毒液中滴加少量白醋可增强漂白性:ClO- +H+=HClO
C. 氨水吸收少量SO2防止污染空气:NH3·H2O+SO2=NH4++SO32-+H2O
D. 4 mol/L的NaAlO2 溶液和7 mol/L的HCl溶液等体积反应:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
难度: 中等查看答案及解析