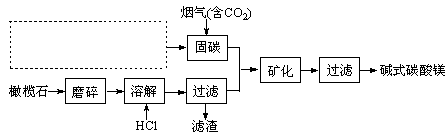
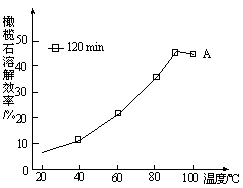
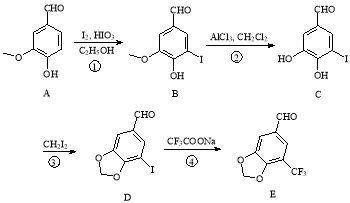
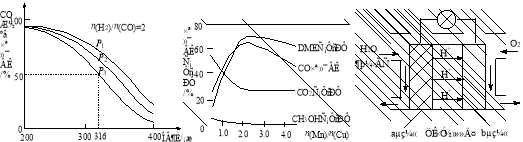
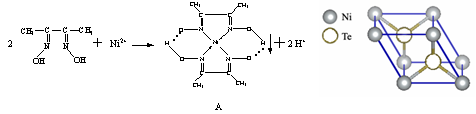
-
化学与技术、社会和环境密切相关。下列说错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.充分开发利用天然纤维,停止使用各种化学合成材料
D.加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.氯化铵的电子式:
B.中子数为21的钾原子:
C.甲烷分子的球棍模型:
D.HCO3-水解的离子方程式:HCO3-+H2O
H2CO3+H3O+
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的KI溶液: Na+、Ag+、NO3-、SO42-
B.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl-
C.0.1 mol·L-1的KMnO4溶液:Na+、K+、Cl-、SO32-
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质的应用错误的是
A.Al2O3的熔点很高,可用于制造耐火材料
B.H2O2有氧化性,可用于杀菌消毒
C.常温下,铝遇浓硫酸会钝化,可用铝槽车运输浓硫酸
D.Na2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
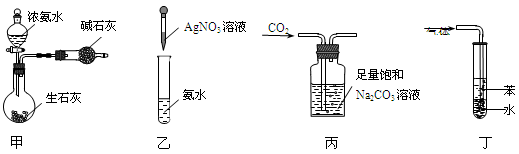
A.用图甲装置制取干燥的氨气
B.用图乙装置配制银氨溶液
C.用图丙装置除去CO2中含有的少量HCl
D.用图丁装置吸收NH3,并防止倒吸
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是
①
②
③
④
甲
C
N2
S
Fe
丙
CO2
NO2
SO3
Fe(NO3)3
A.①② B.②③ C.①④ D.③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol羟基(
)中含有的电子数为0.7 NA
B.1 L 0.1 mol·L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA
C.0.1 mol N2与足量H2反应,转移的电子数为0.6 NA
D.标准状况下,1.12 L HCHO中C原子的数目为0.05 NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.向新制Cu(OH)2中加入乙醛溶液并加热:
CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O
难度: 中等查看答案及解析
-
电浮选凝聚法处理污水的原理如图所示。电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体。下列说法正确的是
A.可以用铝片或铜片代替铁片
B.阳极产生的气体可能是O2
C.电解过程中H+向阳极移动
D.若污水导电能力较弱,可加入足量硫酸
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,X与Z同主族,Y和氢元素同主族,W原子的最外层电子数比次外层电子数少1。下列说法正确的是
A.元素X形成的单质一定是原子晶体
B.原子半径的大小顺序:r(W)>r(Z)>r(Y) >r (X)
C.Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:2
D.W分别与Y、Z形成的化合物中含有的化学键类型相同
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g)
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向苯酚浊液中加入Na2CO3溶液 溶液变澄清 酸性:苯酚> HCO3-
B 向乙醇中加入浓H2SO4,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液 KMnO4溶液
褪色 该气体是乙烯
C 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 试纸不变蓝 溶液X中无NH4+
D 用湿润的淀粉碘化钾试纸检验气体Y 试纸变蓝 气体Y是Cl2
难度: 中等查看答案及解析
-
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是
A.丹参素的分子式为C9H10O5
B.丹参素能发生缩聚、消去、氧化反应
C.1 mol丹参素最多可以和4 mol H2发生加成反应
D.丹参素分子中含有手性碳原子
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)
C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者
D.浓度均为0.1 mol·L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>①
难度: 困难查看答案及解析
-
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
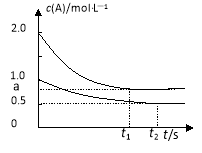
容器
甲
乙
容积(L)
0.5
0.5
反应放热(kJ)
Q1
Q2
反应物起始量
1 molA
1 molB
0.5 molA
0.5 molB
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
难度: 中等查看答案及解析