-
党的十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”。为了实现这一目标,从化学的角度分析,下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.加快化石燃料的开采与使用
C.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
D.为提高农作物的产量和质量,应大量使用化肥和农药
难度: 简单查看答案及解析
-
元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。
下列推测不正确的是
A.在短周期元素中X的金属性最强
B.Y的最高价含氧酸属于弱酸
C.原子半径Z>Y,离子半径Z2-> X+
D.Y、Z都可与氢元素形成氢化物,Z的氢化物比Y的氢化物稳定
难度: 简单查看答案及解析
-
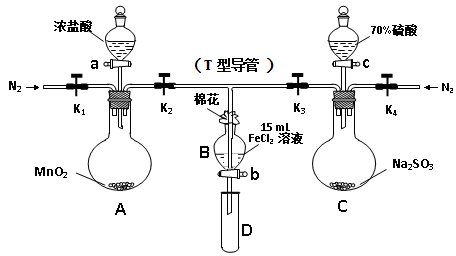
下列装置能达到实验目的的是

A.除去乙醇中的苯酚 B.制取金属锰
C.实验室制氨气 D.从碘的CCl4溶液中分离I2
难度: 简单查看答案及解析
-
下列对各种平衡体系的叙述中,不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
B某温度下,容积一定的密闭容器中进行可逆反应,X(g) +Y(g)
2Z(g)+W(s)
平衡后,升高温度,c(Z)增大
C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
难度: 简单查看答案及解析
-
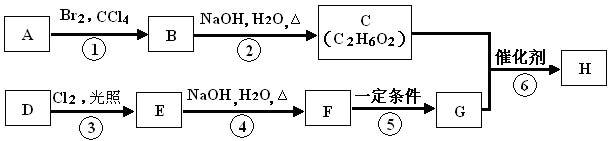
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:

下列分析判断正确的是
A.分离提纯有机物丙宜在NaOH热溶液中进行
B.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素
C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙
D.PbCl2的作用是提高反应物的活性,加快反应速率
难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是
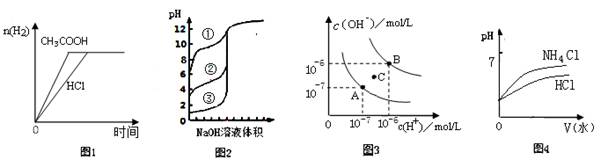
A.图1中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图2表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强
C.图3为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图4表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者 pH的变化
难度: 简单查看答案及解析