-
某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A.第四周期ⅡA族 B.第三周期ⅣA族
C.第三周期ⅥA族 D.第二周期ⅣA族
难度: 中等查看答案及解析
-
下列过程表达式中,属于电离方程式的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
B.在滴有酚酞溶液的氨水里,加入NH4Cl溶液恰好无色,则此时溶液的pH<7
C.95℃纯水的pH<7,说明加热可导致水呈酸性
D.0.2 mol·L-1的盐酸与等体积水混合后pH=1
难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是
A.1s2 B.
C.He D.
难度: 中等查看答案及解析
-
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入 CH4的一极,其电极反应式是CH4+10OH--8e-===CO32-+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-===8OH-。下列叙述不正确的是
A.正极发生还原反应
B.通入CH4的电极为负极
C.该电池使用一段时间后应补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动
难度: 困难查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O
HCO3-+OH-。下列说法正确的是
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高温度,
减小
D.加入NaOH固体,溶液pH减小
难度: 中等查看答案及解析
-
等体积等物质的量浓度MOH强碱和HA弱酸溶液混合后,混合液中有关离子浓度应满足的关系 是
A.c(M+)>c(H+)>c(A-)>c(OH-) B.c(M+)>c(A-)>c(OH-)>c(H+)
C.c(M+)>c(OH-)>c(A-)>c(H+) D.c(M+)>c(A-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
25℃时pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得混合液的pH=11,则NaOH溶液与 H2SO4溶液的体积比是
A.1∶9 B.1∶11 C.9∶1 D.11∶1
难度: 中等查看答案及解析
-
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为
A.1 B.3 C.4 D.6
难度: 中等查看答案及解析
-
下列有关金属腐蚀与保护的说法正确的是
A.钢铁在潮湿空气中发生吸氧腐蚀,负极反应为Fe-3e-===Fe3+
B.相同条件下,轮船在海水中比在淡水中腐蚀慢
C.铁上镀锌的保护方法叫牺牲负极的正极保护法
D.水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法
难度: 中等查看答案及解析
-
下列关于电解质溶液中离子关系的说法正确的是
A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
难度: 困难查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的
A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
C.滴定过程中,锥形瓶中有溶液溅出
D.酸式滴定管未用标准盐酸润洗
难度: 中等查看答案及解析
-
下列元素性质的递变规律正确的是
A.第一电离能:B<Be<Mg<Na
B.元素的电负性:O>N>S>P
C.气态氢化物的稳定性:NH3<CH4<PH3<SiH4
D.原子半径:Be<B<C<N
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
C.正极上发生的反应为:O2+4e-+2H2O===4OH-
D.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
难度: 中等查看答案及解析
-
25℃时,向纯水中加入NaOH,使溶液的pH为11,则该溶液中由NaOH电离出的c(OH-)与由水电离出的c(OH-)之比为
A.108∶1 B.5×109∶1 C.1010∶1 D.1∶1
难度: 中等查看答案及解析
-
下列说法正确的是
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B.Fe3+的最外层电子排布式为3s23p63d5
C.基态铜原子的最外层的电子排布图:
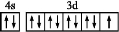
D.所有非金属元素都分布在p区
难度: 中等查看答案及解析
-
下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
难度: 中等查看答案及解析
-
下列有关沉淀平衡的说法中正确的是
A.在AgCl的沉淀溶解平衡体系中加入蒸馏水,Ksp(AgCl)增大
B.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,平衡不移动
C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小
D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成
难度: 中等查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
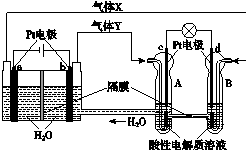
A.b极上发生的电极反应是:4H2O+4e-===2H2↑+4OH-
B.d极上发生的电极反应是:O2+4H++4e-===2H2O
C.c极上进行还原反应,B中的H+可通过隔膜进入A
D.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.用惰性电极电解
溶液分别得到单质
和Cl2
B.常温下,某溶液中由水电离出的
,该溶液一定呈酸性
C.
溶液和
溶液加热蒸干、灼烧都得到
D.在
饱和溶液中加入
溶液,达到平衡时,溶液中
浓度降低
难度: 中等查看答案及解析
-
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为
难度: 中等查看答案及解析
-
1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
A.电解质AgNO3溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子
D.反应中有0.01mol的Ag被氧化
难度: 中等查看答案及解析
-
对于物质的量浓度均为0.01 mol·L-1的①NaHCO3、②Na2CO3、③CH3COOH、④CH3COONa 四种溶液,下列说法正确的是
A.①的离子浓度为:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.②升高温度,
减小
C.③加入等体积的水稀释,电离平衡正向移动,c(H+)增大
D.④和③等体积混合,溶液pH<7,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
难度: 困难查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。
I1
I2
I3
I4
……
R
740
1 500
7 700
10 500
……
下列关于元素R的判断中一定正确的是
A.R的最高正价为+3价
B.R元素位于元素周期表中第ⅡA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为1s22s22p1
难度: 中等查看答案及解析
-
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
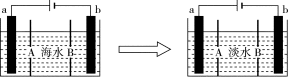
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O
难度: 中等查看答案及解析
-
(10分)如图为相互串联的甲、乙两电解池。
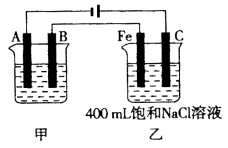
试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),B是 (填电极材料),应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色。乙电解池的电解方程式为 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于 。
难度: 中等查看答案及解析