-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
A. 重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩
B. 小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂
C. 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D. 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 碳基硫的电子式:
B. 乙醛分子的比例模型:

C.
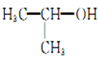 的名称:2-甲基乙醇
的名称:2-甲基乙醇D. 氢化钠与重水反应的化学方程式:NaH+D2O=NaOH+D2↑
难度: 简单查看答案及解析
-
下列有关物质的性质和用途的描述均正确的是( )
A. 二氧化锰具有强氧化性.能将双氧水氧化为氧气
B. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C. 炭具有还原性,可用炭在高温下将二氧化硅还原为硅
D. .汽油是常见的有机溶剂,可以用裂化汽油来萃取漠水中的溴
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. NaHSO4溶液与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C. K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+=37Cl-+3Cl2↑+3H2O
D. 4mol·L-1的NaAlO2溶液与7mol·L-1的盐酸等体积互相均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
难度: 简单查看答案及解析
-
下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )

A. 用装置甲制取氨气 B. 用装置乙除去氨气中的水蒸气
C. 用装置丙验证氨气具有还原性 D. 用装置丁吸收尾气
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
B. 标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023
C. 控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池。当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极

D. 向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS)
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+1/2O2(g)═CO2(g)+2H2(g);△H=-192.9kJ/mol
下列说法正确的是

A.CH3OH的燃烧热为192.9kJ/mol
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ/mol
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
① FeS2
SO2
H2SO4
② SiO2
SiCl4
Si
③ 饱和NaCl溶液
NaHCO3
Na2CO3
④ 1 mol·L-1HCl(aq)
Cl2
Ca(ClO)2
⑤ CuSO4(aq)
Cu(OH)2
Cu2O
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
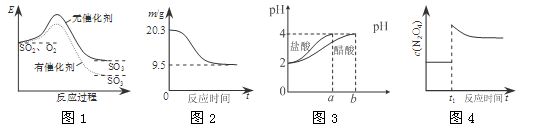
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D.图4表示平衡2NO2(g)
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
难度: 中等查看答案及解析
-
尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如下转化:
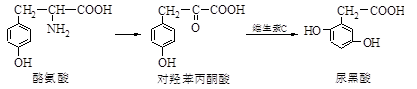
下列说法错误的是( )
A. 酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B. 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C. 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D. 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.
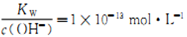 的溶液中:Na+、K+、AlO2-、NO3-
的溶液中:Na+、K+、AlO2-、NO3-B. 含有大量Fe3+的溶液中:NH4+、I-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42-、NO3-
D. 0.1mol·L-1Na2SO3的溶液中:H+、Ca2+、Fe2+、Cl-
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶
非金属性:Cl>Si
B
向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色
KCl溶液具有碱性
C
在CuSO4溶液中滴加KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色
白色沉淀可能为CuI
D
某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀
该溶液中可能不含SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
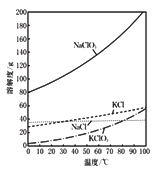
25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
难度: 中等查看答案及解析
-
一定温度下向体积为2L的恒容密闭容器中充入6 molCO2和8mo1H2,发生反应:CO2 (g)+3 H2(g)= CH3OH(g)+H2O(g) △H=-49kJ·mol-1。测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )

A. 该反应在O~8min内的v(CO2)=0.125mol·L-1·min-1
B. 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20%
C. 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D. 曲线II、曲线III改变条件分别是升高温度、减小压强
难度: 中等查看答案及解析

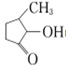 可形成配合物。
可形成配合物。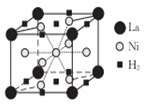
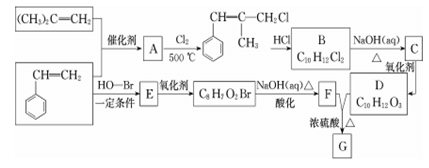
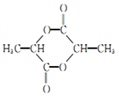 的合成路线:_______。
的合成路线:_______。