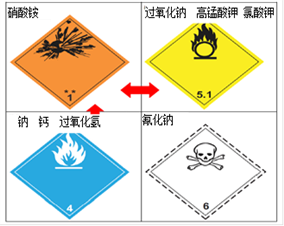
-
下列说法不正确的是( )
A. 用胆矾炼铜、烧结粘土制陶瓷都涉及化学变化
B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C. 食盐、醋酸、氨水和硫酸钡都是电解质
D. 胶体区别其它分散系的本质特征是分散质微粒直径在1nm~100nm之间
难度: 简单查看答案及解析
-
下列物质在生活中应用时,起还原作用的是( )
A. 明矾作净水剂
B. 甘油作护肤保湿剂
C. 食醋除水垢
D. 铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
下列指定微粒的数目相等的是( )
A. 等物质的量的水与重水含有的中子数
B. 等物质的量的乙烯和丙烯中含有的共用电子对数
C. 同温、同压、同体积的CO和NO含有的质子数
D. 等物质的量的钠分别和足量的氧气反应生成的氧化钠和过氧化钠
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g) ΔH=-a kJ·mol-1
已知:

(a、b、c均大于零)
下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C. 断开2 mol H—I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
难度: 中等查看答案及解析
-
①2Na+2H2O=2NaOH+H2↑
②2H2O
2H2↑+O2↑
③2F2+2H2O=O2+4HF
④3NO2+H2O=2HNO3+NO
⑤NaH+H2O=NaOH+H2↑
⑥2Na2O2+2H2O=4NaOH+O2↑
A. ③④⑥ B. ②③⑤ C. ①②③⑤ D. ④⑥
难度: 简单查看答案及解析
-

A. 过氧化钠 B. 氧化钠
C. 钠 D. 钾
难度: 简单查看答案及解析
-
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )mol/L
A.
B.
C.
D.
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,以下说法正确的是( )
A. 氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢气分子的质量之和
B. 常温常压下1 mol NO2气体与水反应生成NA个NO3-离子
C. 121g CCl2F2所含的氯原子数为2NA
D. 62g Na2O溶于水后所得溶液中含有O2-离子数为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C. 0.1 mol•L-1AgNO3的溶液:H+、K+、SO42-、I-
D. 0.1 mol•L-1的NaAlO2溶液:H+、Na +、Cl-、SO42-、
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,将丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
A. Al2(SO4)3 B. NaOH C. BaCl2 D. FeSO4
难度: 中等查看答案及解析
-
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH=xkJ·mol-1
已知碳的燃烧热ΔH1=akJ·mol-1
S(s)+2K(s)=K2S(s)ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s)ΔH3=ckJ·mol-1则x为
A. 3a+b-c B. c-3a-b C. a+b-c D. c-a-b
难度: 中等查看答案及解析
-
不能正确表示下列反应的离子方程式是( )
A. Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑
B. Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑
C. 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3-
难度: 中等查看答案及解析
-
下列化学实验事实及其解释不正确的是( )
A. 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B. 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C. 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2 的反应是放热反应
D. 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O再与水和二氧化碳反应
难度: 中等查看答案及解析
-
过氧化钠可作为氧气的来源,常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
选项
二氧化碳
碳酸钠
转移的电子
A
lmol
2NA
B
22.4L
lmol
C
106g
lmol
D
106g
2NA
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应与Na2O2+SO2=Na2SO4相比较,Na2O2的作用相同的是
A. 2Na2O2+CO2=2Na2CO3+O2
B. 2Na2O2+2SO3=2Na2SO4+O2
C. Na2O2+H2SO4=Na2SO4+H2O2
D. 3Na2O2+Cr2O3=2Na2CrO4+Na2O
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3说法中,正确的是( )
A. 两者都能溶于水并且都能和水反应,前者的溶解度大于后者
B. 两者都能用于治疗胃酸过多疾病,前者的效果好于后者
C. 足量的Na2CO3和NaHCO3分别与等物质的量的稀盐酸反应,前者产生CO2多
D. 等体积等浓度的AlCl3溶液分别和足量的Na2CO3和NaHCO3反应,前者产生CO2多
难度: 中等查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于某一反应中的反应物和生成物。下列叙述不正确的是( )
A. 该反应一定为氧化还原反应
B. 若NH4+为产物,则Fe3+也是产物
C. 该反应过程中,溶液的pH不断增大
D. 该反应的离子方程式中,Fe2+、NH4+两者计量数之比为1:8
难度: 困难查看答案及解析
-
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
难度: 简单查看答案及解析
-
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A. 被氧化的砒霜为1.98 mg
B. 分解产生的氢气为 0.672 mL
C. 和砒霜反应的锌为3.90 mg
D. 生成砷化氢时,转移的电子总数为6×10-5NA
难度: 中等查看答案及解析
-
在25℃、1.01×105Pa下,将22gCO2通入到750mL 1.0 mol·L-1的NaOH溶液中充分反应,放出x kJ热量。在该条件下1molCO2通入到2L 1.0 mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为] ( )
A. CO2(g) + NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B. CO2(g) + NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
C. CO2(g) + NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
D. CO2(g) + NaOH(aq)=NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1
难度: 困难查看答案及解析