-
化学与生产、生活密切相关。下列有关叙述正确的是
A.大气雾霾污染现象的产生与汽车尾气排放有关
B.玻璃和氮化硅陶瓷都属于新型无机非金属材料
C.空气中的臭氧对人体健康有益无害
D.活性炭与二氧化硫都可用于漂白,其漂白原理相同
难度: 中等查看答案及解析
-
下列用品的有效成分及用途对应错误的是
A B C D
用品

有效成分 NaCl Na2CO3 Al(OH)3 Ca(ClO)2
用途 做调味品 做发酵粉 做抗酸药 做消毒剂
难度: 简单查看答案及解析
-
下列有关说法不正确的是
A.根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质
B.氨气的水溶液能够导电,因此NH3是电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.溶液与胶体的本质区别是分散质颗粒直径大小
难度: 中等查看答案及解析
-
下列说法正确的是(其中NA表示阿伏加德罗常数)
A.质子数相等、中子数不等的微粒一定属于同位素
B.比黄金还贵的18O2和普通的16O2是两种不同的核素
C.常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA
D.对人体有害元素氡的放射性同位素22286Rn,其原子中的质子数为136
难度: 中等查看答案及解析
-
下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同
②标准状况下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③ B.④⑤⑥ C.②③⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.氧化还原反应的本质是有化合价的变化
B.分解反应一定是氧化还原反应
C.利用化合反应可制备FeCl2、Fe(OH)3
D.在一定条件下能向正反两个方向进行的反应称为可逆反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片
B.工业上由NH3制碳铵属于氮的固定中的人工固氮
C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
D.S、P、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
难度: 中等查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.若M+和R2-的核外电子层结构相同,则原子序数R>M
D.主族元素的最高正化合价等于该元素原子的最外层电子数
难度: 中等查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法。某同学用如下表所示的形式对所学知识进行分类,甲与乙、丙、丁是包含关系。其中正确的是
选项 甲 乙、丙、丁
A 弱电解质 一水合氨、水、硝酸钡
B 腐蚀品 浓硫酸、烧碱、硝酸
C 碱性氧化物 过氧化钠、氧化镁;氧化铁
D 合成高分子材料 光导纤维、涤纶、玻璃
难度: 中等查看答案及解析
-
下列对非金属元素(除稀有气体外)的相关判断正确的是
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
A.②⑤ B.①③ C.①⑤ D.③④
难度: 中等查看答案及解析
-
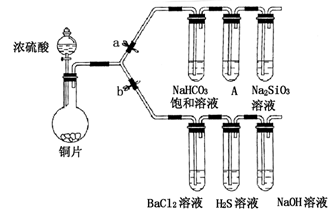
下列物质的分离或鉴别正确的是
A.除去混在氯化钠固体中的氯化铵或单质碘均可用加热升华的方法
B.若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液
C.从海水中提取溴,一般是向浓缩后的海水中通入Cl2,再鼓入热空气或水蒸汽将溴分离出来
D.鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.通过单质Fe与Cl2、S反应的产物可以判断Cl2和S的氧化性强弱
B.向饱和Ca(OH)2溶液中加入一小块钠,溶液中有固体析出
C.浓硫酸在常温下能够使铁、铝等金属钝化
D.干燥的氯气可使湿润的pH试纸退色,说明Cl2具有漂白性
难度: 中等查看答案及解析
-
下列有关做法正确的是
A.将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌
B.实验室制取氯气时,尾气用碱液吸收
C.金属钠、镁着火时,可用泡沫灭火器来灭火
D.夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
难度: 中等查看答案及解析
-
下列有关化学实验叙述正确的是
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.存放浓硝酸时,使用带橡胶塞的棕色玻璃瓶
D.取用化学药品做实验,剩余药品都倒入同一废液缸中
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
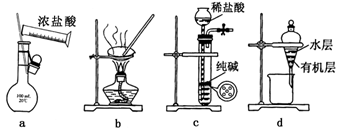
A.用图a所示装置配制100mL0.100mol·L-1稀盐酸
B.用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C.用图c所示装置制取少量纯净的CO2气体
D.用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中不正确的是
A.原子序数A>B>C B.离子半径A2->C->B2+
C.原子半径C>B>A D.最外层电子数C>A>B
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使石蕊试液变红的溶液:Na+、K+、Cl-、CO32-
B.1.0mol·L-1的HNO3溶液:K+、Cu2+、Cl-、SO42-
C.含有I-的溶液:Na+、Fe3+、Cl-、SO42-
D.加入Al能放出H2的溶液:Cl-、SO42-、NO3-、Mg2+
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Cl-
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
难度: 中等查看答案及解析