-
“S.T.P”是指( )
A.20℃,1大气压 B.273K,101.3KPa
C.293K,1大气压 D.0℃,101.3Pa
难度: 简单查看答案及解析
-
下列各项值最精确的是( )
A.S.T.P下,1mol任何气体的体积为22.4L
B.阿佛加德常数为6.02×1023/mol
C.设NA代表阿佛加德罗常数,则1mol H2分子数为NA个
D.S.T.P下,0.5mol CO2的体积为11.2L。
难度: 中等查看答案及解析
-
下列各组中互为同位素的是( )
A.O2和O3 B.1H 和 2H C.H2O和H2O2 D.O2–和O
难度: 简单查看答案及解析
-
某原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A.原子核内中子的总质量小于质子的总质量
B.该原子的质量数等于m-n
C.该元素的相对原子质量近似等于m+n
D.该原子的相对原子质量近似等于m+n
难度: 中等查看答案及解析
-
下列电子层中,能量比M层高的是( )
A.L层 B.K层 C.N层 D.G层
难度: 简单查看答案及解析
-
现有某氯化钠(Na37Cl)6克,其中含钠元素的质量为( )
A.2克 B.2.3克 C.3克 D.都不对
难度: 中等查看答案及解析
-
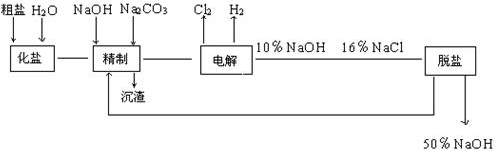
海水晒盐的原理( )
A.利用热蒸发浓缩海水达饱和并进一步结晶
B.通过降温降低食盐的溶解度使食盐析出
C.利用加入沉淀剂的方法是食盐沉淀析出
D.利用泥沙使海水达到饱和,然后利用日光使食盐析出
难度: 简单查看答案及解析
-
下列物质属于强电解质的是( )
A.CH3COOH B.H2O C.AgNO3 D.NH3·H2O
难度: 简单查看答案及解析
-
已知1~18号元素中,元素X、Y最外层分别有n个和(m-5)个电子,次外层分别有(n+2)和m个电子,据此可推断元素x和y能形成化合物的分子式为( )
A.X3Y2 B.X2Y3 C.X2Y D.XY2
难度: 中等查看答案及解析
-
自然界中氧元素有三种同位素16O、17O、18O,氧元素的相对原子质量为15.9994,
由此可知16O的相对原子质量为( )
A.>16 B.<16 C.=16 D.不能确定
难度: 中等查看答案及解析
-
下列物质不能以食盐为原料而生产的是( )
A.盐酸 B.硫酸 C.烧碱 D.纯碱
难度: 中等查看答案及解析
-
称量烧碱时,烧碱必须( )
A.直接放在托盘上 B.放在滤纸上
C.放在烧杯上 D.放在称量纸上
难度: 简单查看答案及解析
-
把生锈的铁钉放入足量稀盐酸中,可能发生的反应是( )
A.只有置换反应 B.只有复分解反应
C.置换和复分解反应 D.置换和分解反应
难度: 中等查看答案及解析
-
由H、D.T和35Cl、37Cl生成的氯化氢用一种仪器测定其分子的质量时,所得的数值应有( )
A.3种 B.2种 C.6种 D.5种
难度: 中等查看答案及解析
-
已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为
下列原子中,与氧元素原子的化学性质相似的是( )

难度: 中等查看答案及解析
-
在常温下,向20L密闭容器中通入a mol H2、b mol O2(a≤4,b≤4,A.b均为正整数),点燃后充分反应恢复至原温度时,容器内气体(水蒸气忽略不计)密度最大值可能是( )
A.5.6 g·L-1 B.9.6 g·L-1 C.11.2g·L-1 D.56 g·L-1
难度: 中等查看答案及解析
-
下列电离方程式错误的是( )
A.HCl →H+ +Cl- B.Al(NO3)3→Al3+ +3NO3-
C.Na2CO3→2Na+ +CO32- D.MgCl2→Mg2+ +Cl22-
难度: 简单查看答案及解析
-
在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿佛加德罗常数可近似表示为( )
A.22.4(m+n) B.22.4×6.02×1023(m+n)
C.22.4(m+n)/(6.02×1023) D.m+n
难度: 中等查看答案及解析
-
有13.6g氯化锌样品(其中混有另一种氯化物),将样品溶于水后加足量的硝酸银溶液,可得沉淀29.5g,则样品中可能含有下列哪一种氯化物( )
A.氯化钾 B.氯化汞 C.氯化镁 D.氯化钡
难度: 中等查看答案及解析
-
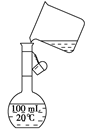
如图表示10ml量筒中液面的位置,A与B,B与C刻度间相差1ml,如果刻度A为4,则量筒中液体的体积是( )
A. 4.8ml B.3.2ml C.3.20ml D.4.80ml
难度: 简单查看答案及解析
-
19世纪,提出近代原子论的科学家是________;英国科学家________提出了原子结构的葡萄干面包模型;________提出了原子结构的行星模型,依据是α粒子散射实验。
难度: 简单查看答案及解析
-
写出电子数为10的微粒符号:
(1)原子:________。
(2)分子:________、________、________、________。
(3)离子:________、________、________。
难度: 中等查看答案及解析
-
A.B.C.D四种元素核电荷数均小于18。B元素是地壳中含量最多的元素,A.C元素的原子最外层电子数相等,C.D元素原子电子层数相同。A原子最外层电子数等于电子层数,C原子最外层电子数是K层上电子数的一半。D元素原子有三个电子层,D-离子电子层结构与氩原子电子层结构相同。则四种元素的名称为:
(1)A________ B________ C________ D________;
(2)A原子、C+离子的结构示意图为________、________;
(3)B原子、D-离子的电子式为________,;
(4)A单质与B单质的化学方程式为________。
难度: 中等查看答案及解析