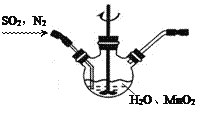
-
下列叙述正确的是
A.原电池中阳离子向负极移动 B.用铝质铆钉接铁板,铁易被腐蚀
C.马口铁(镀锡)表面一旦破损,铁腐蚀加快D.白铁(镀锌)表面一旦破损,铁腐蚀加快
难度: 中等查看答案及解析
-
发射“神六“时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C. N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 568.35kJ/mol
D. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
难度: 中等查看答案及解析
-
某同学为了使反应2HCl + 2Ag
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2。下列对该燃料电池说法正确的是
A. 在熔融电解质中,O2由负极移向正极
B. 通入丁烷的一极是正极,电极反应为:2C4H10+26e+13O2=4CO2+5H2O
C. 通入空气的一极是负极,电极反应为:O2+4e=2O2
D. 电池的总反应是:2C4H10+13O2 8CO2+10H2O
难度: 困难查看答案及解析
-
下列溶液中,一定呈中性的是( )
A. 由非电解质溶于水得到的溶液
B.
均为
的溶液
C. 等物质的量的强酸与强碱反应得到的溶液
D. 将pH =9的烧碱溶液稀释100倍所得到的溶液
难度: 中等查看答案及解析
-
往某恒温密闭容器中加入CaCO3,发生反应:

反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是

A.v逆 B.c(CO2)
C.
D.
(容器内气体密度)
难度: 困难查看答案及解析
-
往含I一和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3
溶液的体积V( AgN03)的关系如图所示。已知:Ksp(AgCl)=1.8×l0-10, Ksp( AgI) =l.5xl0-16,则原溶液中c(I一)/c(Cl-)的比值为

A. (V2- Vl)/Vl B. Vl/V2 C. Vl/( V2- Vl) D. V2/Vl
难度: 中等查看答案及解析
-
某实验小组为测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量Wg样品进行实验,下列实验方法所对应的实验方案和测量数据最合理的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
100 0
150 0
c(N2O5)/mol·L-1
5.00
3.52
2.50
2.50
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
难度: 困难查看答案及解析
-
为了探究外界条件对反应aX(g)+bY(g)
cZ(g)的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是( )
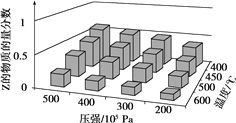
A. ΔH>0,a+b>c B. ΔH>0,a+b<c
C. ΔH<0,a+b>c D. ΔH<0,a+b<c
难度: 中等查看答案及解析
-
体积10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
A. KOH B. CH3COONa C. CuSO4 D. Na2CO3
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
难度: 中等查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法不正确的是( )

A. 醋酸的电离程度:a<b<c
B. 溶液中c(H+):b>a>c
C. a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-)
D. 从b点到c点,溶液中
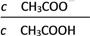 的比值减小
的比值减小难度: 中等查看答案及解析
-
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
难度: 困难查看答案及解析
-
一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
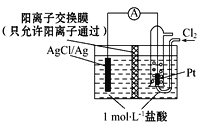
A. 正极反应为AgCl+e-=Ag + Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 困难查看答案及解析
-
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
难度: 简单查看答案及解析
-
室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
难度: 困难查看答案及解析
-
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
N2(g)+CO2(g)ΔH="-373.4" kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
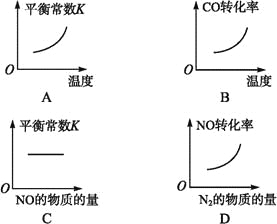
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A.
用热的纯碱溶液洗去油污
Na2CO3可直接与油污反应
B.
源白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与HN4Cl反应生成氨气会降低肥效
D.
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含Cu2+的溶液中置换出铜
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度
甲
乙
丙
c(H2)/mol/L
0.010
0.020
0.020
c(CO2)/mol/L
0.010
0.010
0.020
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 中等查看答案及解析
-
下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
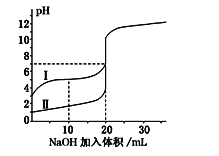
A. Ⅰ表示的是滴定盐酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
CH3OCH3(g)+H2O(g)
容器
编号温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-)。下列说法正确的是( )
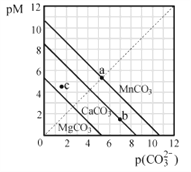
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-)
难度: 困难查看答案及解析