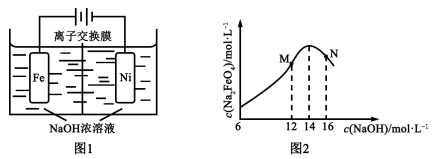
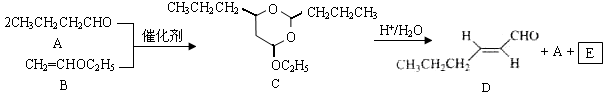
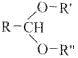
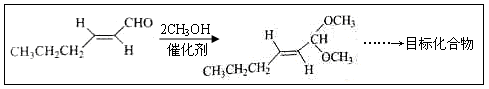
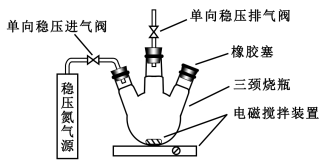
-
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片


古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
难度: 简单查看答案及解析
-
下列对氨基酸和蛋白质的描述正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.氨基酸和蛋白质遇重金属离子均会变性
C.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽
D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
难度: 简单查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基:
+2HCO3-→
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
难度: 简单查看答案及解析
-
下列选用的仪器和药品能达到实验目的的是( )
A
B
C
D




制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
难度: 简单查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 简单查看答案及解析