-
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.Th元素的相对原子质量是231
C.232Th转化成233U是化学变化
D.230Th和232Th的化学性质几乎相同
难度: 简单查看答案及解析
-
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A.分散质粒子直径在1~100nm之间
B.能透过半透膜
C.都是透明的
D.呈红褐色
难度: 简单查看答案及解析
-
下列试剂能贮存在磨口玻璃塞的试剂瓶里的是( )
A. HF溶液 B. KOH溶液 C. 盐酸 D. 水玻璃
难度: 简单查看答案及解析
-
下列有关的叙述正确的是( )
A. HClO是弱酸,所以NaClO是弱电解质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
D. “血液透析”原理与胶体的性质无关
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式是 ( )
A.氢氧化钡与硫酸反应:OH+H+==H2O
B.NaOH溶液中通入少量二氧化碳:CO2+OH==HCO3-
C.氧化铁与盐酸混合:Fe2O3+6H+==2Fe3++3H2O
D.CH3COOH溶液与NaOH溶液反应:OH+H+==H2O
难度: 中等查看答案及解析
-
浓度均为0.01 mol/L硫氰化钾与氯化铁溶液各100 mL在一定条件下反应:3KSCN +FeCl3
Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
A.氯化铁 B.氯化钾
C.硫氰化钾 D.氢氧化钠
难度: 中等查看答案及解析
-
铝分
别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等,反应中消耗的HCl和NaOH物质的量之比为( )
A
.1:1 B.2:1 C.3:1 D.1:3
难度: 中等查看答案及解析
-
向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝
B.溶液先变蓝最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
难度: 中等查看答案及解析
-
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
难度: 困难查看答案及解析
-
下列叙述中不正确的是( )
A. 用石墨作电极电解CuSO4溶液,通电一段时间后,在标准状况下两极产生的气体可能相等
B. 船底镶嵌锌块,锌作负极,以防船体被腐蚀
C. 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
D. 电解池中的阳极和原电池中的负极上都发生还原反应
难度: 简单查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.改变反应条件使平衡向正反应方向移动,反应物的转化率一定增大
B.浓度变化引起平衡向正反应方向移动,反应物的转化率一定增大
C.温度或压强的变化引起平衡向正反应方向移动,反应物的转化率一定增大
D.催化剂可使化学反应速率加快,使反应物的转化率增大
难度: 中等查看答案及解析
-
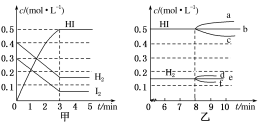
一定温度下,在一容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:
2HI(g)
H2(g)+I2(g)ΔH>0。下列说法正确的是( )
A.若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡
B.容器内的压强不发生变化,表明该反应已达平衡
C.平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大
D.平衡时,若其他条件不变,升高温度,混合气体的颜色加深
难度: 困难查看答案及解析
-
向一固定体积的密闭容器中通入a mol N2O4气体,在密闭容器内发生反应:N2O4(g)
2NO2(g),达到平衡时再通入a mol N2O4气体,再次达到平衡时,与第一次达平衡时相比,N2O4的转化率( )
A.不变 B.增大 C.减小 D.无法判断
难度: 中等查看答案及解析
-
要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为()
①加人少量氯水 ②加人少量KMnO4溶液 ③加人少量KSCN溶液
A.①③ B.③② C.③① D.②①
难度: 中等查看答案及解析
-
现有两瓶失去标签的Na2CO3和NaHCO3无色的饱和
溶液,请提出简便的鉴别方法,其中不合理的是( )
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量
的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
A.①② B.③⑥ C.④⑤ D.②⑤
难度: 中等查看答案及解析
-
向a mL0.25mol·L-1的AlCl3溶液中加入金属钠,反应完全后,恰好只形成NaCl和NaAlO2的混合溶液,则加入金
属钠的物质的量为( )
A.2.5a×10-4mol B.a×10-3mol C.7.5a×10-4mol D.a×10-4mol
难度: 简单查看答案及解析
-
有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
①
He -268.8
(a)-249.5
Ar -185.8
Kr 151.7
②
F2-187.0
Cl2-33.6
(b)58.7
I2184.0
③
(c)19.4
HCl -84.0
HBr -67.0
HI -35.3
④
H2O 100.0
H2S -60.0
(d)-42.0
H2Te -1.8
⑤
CH4-161.0
SiH4-112.0
GeH4-90.0
(e)-52.0
对应表中内容,下列叙述中正确的是
A.a、b、c代表的化学物中均含化学键
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.上表中物质HF和H2O,由于化学键的影响,其沸点出现反常现象
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性Y>X
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素形成的单核离子半径由大到小的顺序为:Z3->W2->X2+>Y3+
难度: 简单查看答案及解析
-
只用一种试剂(可加热)就能将NH4C1、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是 ( )
A.NaOH溶液 B.AgNO3溶液 C.Ba(OH)2溶液 D.BaCl2溶液
难度: 中等查看答案及解析
-
某小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2>T1
难度: 困难查看答案及解析
-
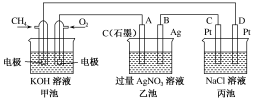
下列装置所示的实验中,能达到实验目的的是

难度: 中等查看答案及解析