-
硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O4的化学性质.
[提出问题]Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
[实验探究]取适量Na2S2O4晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
[实验结论]探究①:______.实验操作 实验现象 现象解释(用离子方程式表示) 探究① A.______ a.溶液pH=8 i.______ B.向pH=2的硫酸中滴加Na2S2O3溶液 b.______ ii.S2O32一+2H+═
S↓+SO2↑+H2O探究② C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 c.氯水颜色变浅 iii.______
探究②:______.
[问题讨论]
(1)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案是否正确并说明理由______.
(2)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化.你的方案______.难度: 中等查看答案及解析
-
A、B、C、D、E为原子序数依次增大的五种短周期元素.A、E同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D最外层电子数之和与E的核外电子总数相等.
试回答:
(1)化合物ABC中σ键和π键个数比为______,它属于______分子(填“极性”或“非极性”).化合物C2A2是一种高能量分子,且C 原子满足8 电子稳定结构.写出C2A2的电子式______.
(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH______(填“增大”、“减小”或“不变”).
(3)在0.1mol•L-1E2BD3的溶液中,各离子浓度由大到小的顺序是______;分子式为 A2B2D4的化合物,与等物质的量的 KOH 溶液反应后溶液呈酸性,其原因是(用文字填空)______.
(4)某密闭容器中发生如下反应:C2(g)+3A2(g)⇌2CA3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______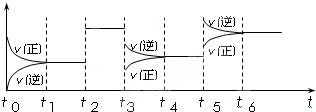
A.t5时增大了压强 B.t3时降低了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式______.难度: 中等查看答案及解析
-
有机合成在现代工、农业生产中占有相当重要的地位,有机物F是一种高分子化合物,可作增塑剂,H是除草剂的中间产物,它们的合成路线如下:
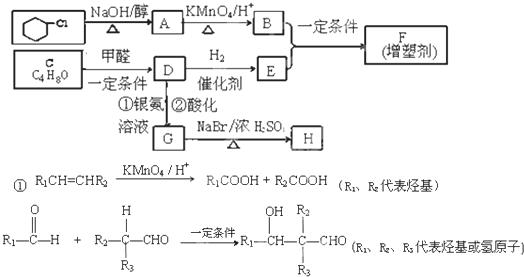
③C能发生银镜反应,且分子中有支链.
请回答:
(1)E中有______种化学环境不同的H原子,D→G的反应类型是______.
(2)D分子中所含官能团的名称是:______.
(3)写出由一氯环己烷到A的化学方程式:______.
(4)写出满足下列条件的D的一种同分异构体的结构简式______.
①与D具有相同的官能团;
②分子中具有两个手性碳原子(连接四个不同原子或基团的碳原子,称为手性碳原子).
(5)G和H的相对分子质量相差63,H能与NaHCO3溶液反应,则0.1moLH与足量NaOH溶液反应,消耗NaOH______mol.
(6)B与E在一定条件下生成F的反应的化学方程式是:______.难度: 中等查看答案及解析
-
目前,我国西南三省正遭遇百年未遇的干旱,对于淡水资源的开源节流显得前所未有的迫切.日常生活中我们选用不同的物质对水资源进行处理.
(1)明矾(KAl(SO4)2.12H2O)是我们生活中最广泛使用的净水剂,用离子方程式表示明矾净水的原理:______;写出明矾溶液中的电荷守恒是______.
(2)Cl2常用作消毒剂是因为它能与水作用生成HClO,写出其离子方程式:______;在氯水中加入碳酸钙可以使得消毒效果更好,用化学平衡原理简述其原因:______.
(3)用铁酸钠(Na2FeO4)对来自江河湖泊的淡水消毒净化是城市饮用水处理的新技术,铁酸钠可用Fe(NO3)3、NaOH和Cl2在一定条件下制得,写出该化学反应方程式:______.
(4)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.ClO2常采用电解饱和食盐水的方法制备,写出阳极反应方程式:______.难度: 中等查看答案及解析