-
下列物质属于电解质的是
A.氧气 B.氯化氢 C.二氧化硫 D.铜
难度: 简单查看答案及解析
-
下列仪器“0”刻度位置正确的是
A.在量筒的上端 B.在滴定管上端
C.在托盘天平分度盘的正中 D.在容量瓶的上端
难度: 简单查看答案及解析
-
在给定的溶液中加入以下各种离子,各离子能大量共存的是
A.滴加甲基橙试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
B.pH=1的溶液: Cu2+、Na+、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
难度: 中等查看答案及解析
-
下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是
A.未用标准液润洗滴定管
B.盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失
C.锥形瓶用蒸馏水洗,未用待测液润洗
D.振荡时锥形瓶中液滴飞溅出来
难度: 中等查看答案及解析
-
氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.无水氯化铁 B.氢氧化铁 C.氧化亚铁 D.氧化铁
难度: 中等查看答案及解析
-
已知S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2,
△H1和△H2的大小关系为
A.△H1﹥△H2 B.△H1﹤△H2 C.△H1﹦△H2 D.无法确定
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合pH由小到大顺序排列的是
A.Na2CO3 、NaHCO3、NaCl、NH4Cl
B.NaHCO3、Na2CO3 、NH4Cl、NaCl
C.NH4Cl、(NH4)2SO4、Na2S、NaNO3
D.(NH4)2SO4、NH4Cl、NaNO3、Na2S
难度: 中等查看答案及解析
-
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是
A.自来水 B.0.5mol·L—1KOH溶液
C.0.5mol·L—1醋酸 D.0.5mol·L—1NH4Cl溶液
难度: 中等查看答案及解析
-
将2molSO2和2molSO3气体,混合于一固定体积的密闭容器中,在一定条件下发生反应:2SO2+O2
2SO3平衡时SO3为W mol;在相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于W mol的是
A.2molSO2 、1molO2 B.4molSO2 、1molO2
C.2molSO2 、1molO2 、2mol SO3 D.1molSO2 、2mol SO3
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Zn(s)+O2(g)=ZnO(s) ΔH=-Q1 kJ / mol
Hg(l)+O2(g)=HgO(s) ΔH=-Q2kJ / mol
Zn(s)+HgO(s)=Hg(l) +ZnO(s) ΔH=-Q3kJ / mol
Q3值为
A.Q2 - Q1 B.Q1+ Q2 C.Q1- Q2 D.-Q1- Q2
难度: 中等查看答案及解析
-
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)

A.13、7、1 B.12、7、2
C.1、7、13 D.7、13、1
难度: 中等查看答案及解析
-
向水中加入等物质的量Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为
A.8∶1 B.2∶1 C.1∶1 D.1∶2
难度: 中等查看答案及解析
-
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O和O=O键的键焓△H分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) △H =-485kJ/mol
B.H2O(g)=H2(g)+1/2O2(g) △H =+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g) △H =+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol
难度: 中等查看答案及解析
-
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -)
D.温度升高,c(HCO3- )增大
难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),p(CO32-)=-lgc(CO32-)。下列说法正确的是
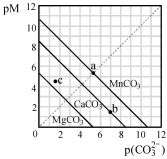
A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)=c(CO32-)
难度: 中等查看答案及解析
-
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下图所示,下列说法正确的是

A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH—,Z表示H+
D.该混合溶液中:c(A—)+ c(Y)=c(Na+)
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,下列研究目的和示意图相符的是
A
B
C
D
研究目的
压强对反应的影响(p2>p1)
温度对反应的影响
平衡体系增加O2的浓度对反应的影响
体积恒定的密闭容器中催化剂对反应的影响
示
意
图




难度: 中等查看答案及解析
-
下列表述正确的是
A.将 0.1 mol·L-1HCl溶液加热到100℃,溶液的pH仍为1
B.将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低
C.常温下,若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12
D.在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性
难度: 中等查看答案及解析
-
向CH3COONa稀溶液中分别加入少量下列固体(忽略温度与体积变化),可以使
的比值减小的是
A.KOH B.冰醋酸
C.CH3COONa D.NaHSO4
难度: 中等查看答案及解析
-
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
已知:25 ℃,Ksp [M(OH)2]=3.2×10-11,则此温度下M(OH)2饱和溶液的pH 等于
A.10 B.10+lg2
C.10+2×lg2 D.10-2×lg2
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A.电解硫酸时,阳极产生1molH2时,阴极一定产生0.5molO2
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C.电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
难度: 中等查看答案及解析
-
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)
CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是

A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T3>T1
D.P1>P4 T2>T3
难度: 中等查看答案及解析
-
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为a克,则a值为

A.14.4 B.10.4 C.12.4 D.14.0
难度: 中等查看答案及解析
-
下图所示的实验,能达到实验目的的是
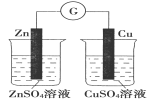
验证化学能转化为电能
A
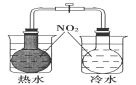
验证温度对化学平衡的影响
B
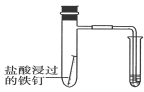
验证铁钉发生吸氧腐蚀
C
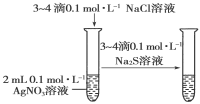
验证AgCl溶解度大于Ag2S
D
难度: 中等查看答案及解析




