-
下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
难度: 简单查看答案及解析
-
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
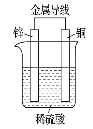
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是
A.在酸性环境下,钢铁只能发生析氢腐蚀
B.金属腐蚀的实质是金属失去电子被还原的过程
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法
D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-===Fe3+,继而形成铁锈
难度: 中等查看答案及解析
-
一定温度下,反应N2(g)+O2(g)==2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A.降低体系温度 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
难度: 简单查看答案及解析
-
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
难度: 中等查看答案及解析
-
下图是关于反应A2(g)+3B2(g)
2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
D.增大反应物浓度,同时减小生成物浓度
难度: 简单查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)==CO2(g) △H1 C(s)+1/2O2(g)==CO(g) △H2
②S(s)+O2(g)==SO2(g) △H3 S(g)+O2(g)==SO2(g) △H4
③H2(g)+1/2O2(g)==H2O(l) △H5 2H2(g)+O2(g)==2H2O(l) △H6
④CaCO3(s)==CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)==Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
难度: 中等查看答案及解析
-
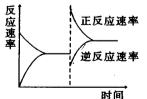
可逆反应:A(g)
B(g),其反应过程中能量变化如下图所示,下列说法错误的是
(以Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)
A.该反应的 ΔH = Ea(正) - Ea(逆)
B.该反应的Ea(正) = E3 - E2
C.只要温度升高,该可逆反应就会向逆反应方向进行
D.可逆反应B(g)
A(g)的ΔH = E2 - E1
难度: 简单查看答案及解析
-
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g)
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
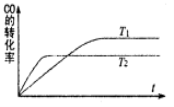
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
难度: 中等查看答案及解析
-
COCl2(g)
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
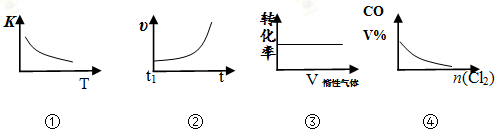
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
难度: 困难查看答案及解析
-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A.H2O(g)===H2(g)+
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
难度: 中等查看答案及解析
-
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
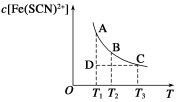
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为
Fe3+(aq)+SCN—(aq)
Fe(SCN)2+(aq) ΔH >0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正>υ逆
D.A点与B点相比,A点的c(Fe3+)大
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)
A2(g)+3B2(g) ΔH>0,下列图像正确的是

难度: 简单查看答案及解析
-
某原电池装置如下图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
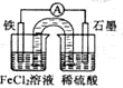
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针有偏转
难度: 中等查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是
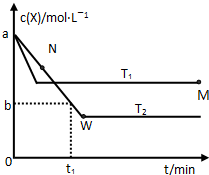
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
难度: 困难查看答案及解析
-
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 1:3 B.2:3 C.3:2 D.3:1
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
15.0
20.0
25.0
30.0
35.0
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/10-3mol/L
2.4
3.4
4.8
6.8
9.4
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
难度: 中等查看答案及解析