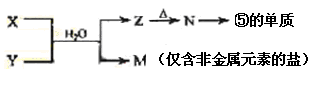-
下列有关说法体现了化学与生产、生活、社会的密切关系。其中不正确的是( )
A.利用焰色反应在绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物。
B.不锈钢和普通钢的主要成分是铁,所以化学性质完全相同
C.铝合金的硬度和强度均高于纯铝
D.氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料。
难度: 简单查看答案及解析
-
日本核事故释放出的极微量人工放射性核素131I,它能引发甲状腺癌;但127I却是人体必需的。127I可阻隔甲状腺吸收放射性131I。碘盐含127I为 30 mg·kg-1,成人一次摄入碘盐约3 kg才有预防效果。 下列有关说法不正确的是( )
A.131I与127I互为同位素
B.相同物质的量的131I与127I的质子数不同
C.131I与127I 是两种不同核素
D.日用碘盐对预防碘辐射起不到有效作用
难度: 简单查看答案及解析
-
下列关于化学键的说法,正确的是( )
A.任何单质中一定含共价键。
B.离子化合物可能含共价键,共价化合物可能含离子键
C.由非金属元素组成的化合物不一定是共价化合物。
D.离子键的本质就是阴阳离子间的静电引力
难度: 简单查看答案及解析
-
下列反应中生成物的总能量大于反应物的总能量的是( )
A.铝粉与氧化铁的反应 B.氯化铵与Ba(OH)2·8H2O反应
C.锌片与稀硫酸反应 D.钠与冷水反应
难度: 简单查看答案及解析
-
下列原子最易形成阴离子的是( )
A. Cl B. F C. C D. O
难度: 简单查看答案及解析
-
无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是( )
A. Cl-、SO42-、Na+、K+ B. K+、Cu2+-、Na+、NO3-
C. HCO3-、Na+、NO3-、K+ D. NO3-、Ba2+、Cl-、NH4+
难度: 简单查看答案及解析
-
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A.可用氧化物形式表示为BaO·CuO·2SiO2 B.性质稳定,不易脱色
C.易溶解于强酸和强碱 D.x等于6
难度: 简单查看答案及解析
-
下列说法正确的是( )
①铝在空气中耐腐蚀,所以铝是不活泼金属
②铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应。
③铝在高温下能还原锰、铁、铬等金属
④两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多。
⑤用过量氨水除去Fe3+溶液中的少量Al3+
⑥Al(OH)3中混有少量Mg(OH)2杂质,可用加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
A.① B.③⑥ C.②④⑥ D.①③④
难度: 简单查看答案及解析
-
A、B两元素可形成AB型化合物,如果A、B两种离子的核外电子数之和为20,则A、B两元素所处的周期可能为 ( )
A.在同一周期
B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期
D.一种在第三周期,一种在第四周期
难度: 简单查看答案及解析
-
设NA为阿附加德罗常数,下列说法正确的是
A.1mol任何氢原子的质量都为1g B.1.8g 铝在化学反应中失去电子数0.2NA
C.28g硅含有6.02×1023个电子 D.1.9g H3O+的质子数为NA
难度: 简单查看答案及解析
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中能以游离态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物性质非常稳定,但在一定条件下可以显氧化性
D.气态氢化物比甲烷稳定
难度: 简单查看答案及解析
-
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是
A.气态氢化物的稳定性:D>C B.四种元素一定属于短周期元素
C.单质的还原性:B>A D.原子序数:b>a>c>d
难度: 简单查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如图,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是
A. X、Y、Z三种元素所形成的单质中,X的单质最稳定
B.Z元素的氧化物对应的水化物是一种强酸
C. Z单质在Y单质中燃烧可反应生成ZY3
D. Z单质与Fe反应生成的化合物中,铁元素显+3价
难度: 简单查看答案及解析
-
0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
难度: 简单查看答案及解析
-
下列结论正确的是:
①粒子半径:S2->Cl>S; ②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2->Cl->Br->I-; ④单质氧化性:Cl2>S; ⑤酸性:H2SO4>HClO4; ⑥碱性强弱:KOH>NaOH>Mg(OH)2。
A.① B.③⑥ C.②④⑥ D.①③④
难度: 简单查看答案及解析
-
等温、等压、等质量的气体:H2、D2,下列叙述中正确的是
①密度之比为l︰2 ②质子数之比为2︰1 ③体积之比为2︰1
A.①②③ B.②③ C.①② D.①③
难度: 简单查看答案及解析
-
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH(溶液),则消耗NaOH(溶液)体积(x轴)和生成沉淀量(y轴)之间的函数关系,可用下图表示,则下列图中正确的是 ( )
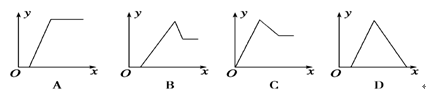
难度: 简单查看答案及解析
-
干燥剂的干燥性能值可用干燥效率(1 m3空气中实际残留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:

根据以上数据,下列叙述错误的是 ( )
A.上述干燥剂中阳离子对干燥效率的影响比阴离子小
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.MgO的干燥性能比CaO好
难度: 简单查看答案及解析
-
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是
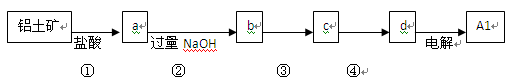
A.①、② 中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
难度: 简单查看答案及解析
-
应用元素周期律,判断下列语句,其中正确的组合是( )
①第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
②砹(At)是第VIIA族,其氢化物的稳定大于HC1
③硒(Se)与氧同主族,而与钙同周期,合成H2S比合成H2Se容易
④ 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(TI)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
A. ①③⑤ B. ①③ C. ①③④⑤ D.全对
难度: 简单查看答案及解析