-
下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI难度: 中等查看答案及解析
-
下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多
D.与s原子轨道的电子相同,p原子轨道电子的平均能量随能层的增大而增加难度: 中等查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键难度: 中等查看答案及解析
-
当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似难度: 中等查看答案及解析
-
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4.一般而言,该式中m大于等于2的是强酸,m为0的是弱酸.下列各含氧酸中酸性最强的是( )
A.H2SeO3
B.HMnO4
C.H3BO3
D.H3PO4难度: 中等查看答案及解析
-
下列关于电子云的说法中,正确的是( )
A.电子云表示电子在原子核外运动的轨迹
B.电子云表示电子在核外单位体积的空间出现的机会多少
C.电子云界面图中的小黑点密表示该核外空间的电子多
D.电子云可表示电子在核外运动的方向难度: 中等查看答案及解析
-
下列各组均有两种物质的式子中,都能真实表示分子组成的是( )
A.CO2和SiO2
B.S和P
C.Na2O2和H2O2
D.C6H6和C6H5Br难度: 中等查看答案及解析
-
以下各组粒子不能互称为等电子体的是( )
A.CO和N2
B.N2H4 和C2H4
C.O3和SO2
D.CO2和N2O难度: 中等查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量高低顺序中正确的是( )
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f)难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A.某些含氢元素的化合物中一定有氢键
B.氢键比分子间作用力强,所以它属于化学键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体性质相同
D.手性异构体分子组成相同难度: 中等查看答案及解析
-
化学知识的总结避免“以偏概全”.你认为下列对化学知识概括合理的是( )
A.只含有极性键的分子一定是极性分子
B.分子晶体中一定是含有共价键
C.第一电离能越大的元素,其非金属性一定越强
D.原子晶体的熔点一定比分子晶体高难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.干冰升华时分子内共价键会发生断裂
B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动难度: 中等查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是( )
A.
B.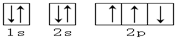
C.
D.
难度: 中等查看答案及解析
-
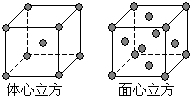
下列有关离子晶体的叙述中不正确的是( )
A.1mol氯化钠中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.平均每个NaCl晶胞中有4个Na+、4个Cl-难度: 中等查看答案及解析
-
下列叙述正确的是( )
①离子化合物可能含有共价键
②分子晶体的粒子中一定含有共价键
③共价化合物中不可能含有离子键
④非极性分子中一定含有非极性键.
A.①②
B.①③
C.②④
D.③④难度: 中等查看答案及解析
-
下列属于配合物的是( )
A.NH4Cl
B.Na2CO3•10H2O
C.CuSO4•5H2O
D.Co(NH3)6Cl3难度: 中等查看答案及解析
-
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子难度: 中等查看答案及解析
-
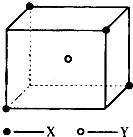
如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
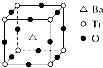
A.8;BaTi8O12
B.8;BaTi4O9
C.6;BaTiO3
D.3;BaTi2O3难度: 中等查看答案及解析
-
关于键长、键能和键角,下列说法不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径有关
C.键能越大,键长越长,共价化合物越稳定
D.键角的大小与键长、键能的大小无关难度: 中等查看答案及解析