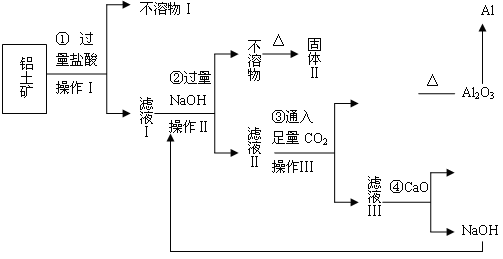
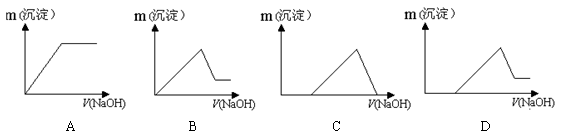
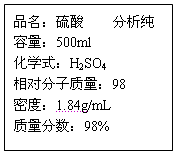
-
为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中
A.饱和食盐水 B.饱和纯碱溶液 C.饱和小苏打溶液 D.浓硫酸
难度: 简单查看答案及解析
-
2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫,他们用撕裂的方法成功获得超薄材料石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料。下列关于石墨烯的说法正确的是
A.石墨烯是从石墨中分离出来的,其性质跟石墨非常相似
B.石墨烯是一种只含碳元素的单质
C.石墨烯与 6C互为同位素
D.石墨烯充分燃烧可生成CO2和H2O
难度: 中等查看答案及解析
-
为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
A. Na+ B.Ca2+ C.Mg2+ D.Fe3+
难度: 中等查看答案及解析
-
下列生活中的化学现象与氧化还原知识有关的是
A.用食醋可以洗水垢(主要成分为CaCO3、Mg(OH)2)
B.蔗糖放在水中片刻后消失了
C.菜刀洗过后如果没擦干放置一段时间就会出现斑点
D.稀盐酸洒在大理石台面上产生大量气泡
难度: 中等查看答案及解析
-
下列有关试剂的保存方法,错误的是
A.碘保存在棕色细口玻璃试剂瓶中
B.少量的钠保存在煤油中
C.新制的氯水通常保存在棕色细口玻璃试剂瓶中
D.氢氧化钠溶液用带橡胶塞的试剂瓶贮存
难度: 中等查看答案及解析
-
熔融烧碱样品应使用下列哪种器皿
A.石英坩埚 B.氧化铝耐高温坩埚 C.生铁坩埚 D.瓷坩埚
难度: 中等查看答案及解析
-
据报道,一科学小组由 31Ga和 83Bi两原子经核聚合,并放出一定数目的中子而制得质量数为275,质子数为114的某原子。则两原子在核聚合过程中放出的中子数目是
A.161 B.5 C.166 D.52
难度: 中等查看答案及解析
-
下列区分Fe(OH)3悬浊液和Fe(OH)3胶体的方法中,正确的是
A.静置片刻出现分层现象的是Fe(OH)3胶体
B.用放大镜观察,颗粒大小为1~100nm的是Fe(OH)3胶体
C.用光束照射,能产生丁达尔现象的是Fe(OH)3胶体
D.看颜色,有色的是Fe(OH)3胶体
难度: 中等查看答案及解析
-
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中
A.Na2CO3 放出的CO2 多 B.NaHCO3 放出的CO2 多
C.Na2CO3 放出CO2 的速度快 D.NaHCO3放出CO2 的速度快
难度: 中等查看答案及解析
-
焰色反应每次实验都要先用某一试剂洗净铂丝,这种试剂是
A.Na2CO3溶液 B.NaOH溶液 C.稀盐酸 D.稀硫酸
难度: 中等查看答案及解析
-
根据水泥和玻璃的生产过程,总结出硅酸盐工业的一般特点是
①原料一定有含硅元素的物质 ②生成物是硅酸盐 ③反应条件是高温 ④发生复杂的物理、化学变化
A.①② B.①②③ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
化学与生活是紧密相联的,下列说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C.为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用
D.今年春天,在我国南方发生了不同程度的旱情,缓解旱情的措施之一是可以用干冰或碘化银进行人工降雨
难度: 中等查看答案及解析
-
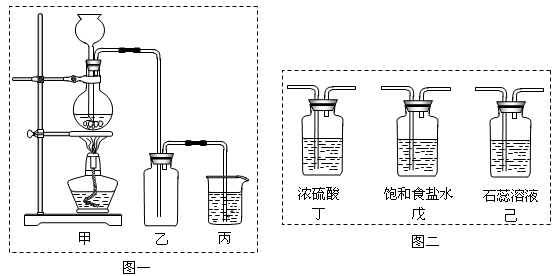
下列实验操作中,能用于互不相容液体分离的是
难度: 中等查看答案及解析
-
下列关于硫酸性质的描述中,正确的是
A.浓H2SO4有氧化性,稀H2SO4无氧化性
B.由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验
C.稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应
D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.1.8g NH4+ 含有的电子数为1NA
B.2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA
C.标准状况下,11.2 L的H2O所含的分子数为0.5NA
D.常温常压下,22.4LCl2与足量的铝充分反应,转移电子数为2NA
难度: 中等查看答案及解析
-
下列属于电解质的一组是
①CuSO4 ②盐酸 ③水银 ④NH3 ⑤氯水 ⑥酒精 ⑦NaOH
A.①⑦ B.①②⑦ C.①④⑦ D.②③⑤⑥⑦
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.金属钠溶于水:2Na+2H2O =2Na++2OH—+H2↑
B.氯化铝溶液与足量氨水反应:Al3+ + 4OH- =AlO2- +2H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Cu2+ +2OH- =Cu(OH)2↓
D.铁与稀硫酸反应:2Fe +6H+ =2Fe3++3H2↑
难度: 中等查看答案及解析
-
只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH、KI五种无色溶液区别分开,这种试剂是
A.BaCl2溶液 B.FeCl2溶液 C.FeCl3溶液 D.Fe(NO3)3溶液
难度: 中等查看答案及解析
-
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32-
C.用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子。
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
难度: 中等查看答案及解析
-
等质量的钠进行下列实验,最终生成氢气最多的是
A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再投入足量水中
C.将钠投入足量稀硫酸中 D.将钠投入足量饱和食盐水中
难度: 中等查看答案及解析
-
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知(1)a、c均能与稀硫酸反应放出气体(2)b与d的硝酸盐反应,置换出单质d(3)c与强碱反应放出气体(4)c、e在冷浓硫酸中发生钝化。由此判断a、b、c、d、e依次为
A.Fe、Cu、Al、Ag、Mg B.Mg、Cu、Al、Ag、Fe
C.Al、Cu、Mg、Ag、Fe D.Mg、Ag、Al、Cu、Fe
难度: 中等查看答案及解析
-
18.6g NaOH和Na2CO3的固体混合物投入200ml 2.0mol·L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的质量为多少
A.25.8g B.11.7g C.23.4g D.无法计算
难度: 中等查看答案及解析