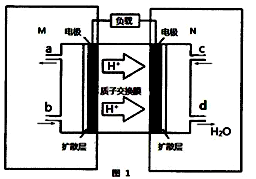
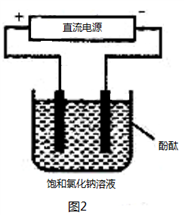
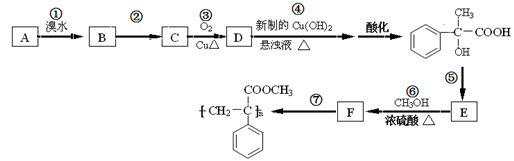
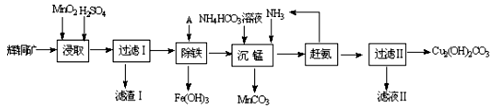
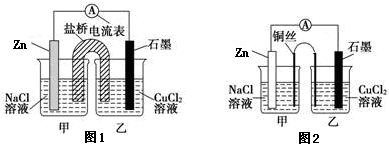
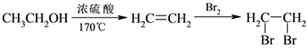-
下列有关酸性氧化物的说法正确的是
A.均不能与酸反应 B.均能与水直接化合生成酸
C.能与碱反应生成盐和水 D.不可能是金属氧化物
难度: 中等查看答案及解析
-
下列物质间相互发生反应时:①Na+O2 ②Fe+O2 ③AgNO3溶液+氨水
④HCOOH+Cu(OH)2 ⑤KI溶液+AgNO3溶液 ⑥
+Br2
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2 ⑩Cu+HNO3;在不同条件下得到不同产物的是
A. 除⑤ B. 除②⑤ C. 除④⑥ D. 除④⑤⑥
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol CH5+(碳正离子)中含有的电子数为11NA
B. 6.8g熔融的KHSO4中含有0.1NA个阳离子
C. 质量相等、密度不等的N2和C2H4两种气体所含的分子数均为NA
D. 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
难度: 中等查看答案及解析
-
能与铝作用放出氢气的溶液中,可能大量共存的离子组是
A. NH4+、Mg2+、NO3-、Cl- B. Cu2+、Na+、HCO3-、Br-
C. Na+、Fe2+、SO42-、NO3- D. K+、Na+、AlO2-、Cl-
难度: 困难查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是
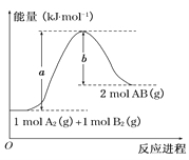
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A2和1 mol B2中的化学键,放出a kJ能量
难度: 中等查看答案及解析
-
一种免疫抑制剂麦考酚酸结构简式如图,下列有关麦考酚酸说法不正确的是
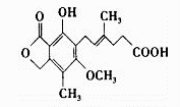
A. 分子式为C17H20O6
B. 能与FeCl3溶液显色,1mol该物质与浓溴水反应,最多消耗量1 mol Br2
C. 1mol麦考酚酸最多与3 mol NaOH反应
D. 在一定条件下可发生加成、加聚、取代、消去四种反应
难度: 困难查看答案及解析
-
在Fe、Cu的混合物中,加入一定量的稀HNO3 并微热。充分反应后剩余金属ag。再向其中加入一定量的稀盐酸并加热,充分振荡后还剩金属bg ,则( )
A. a 可能等于b B. a 一定等于b
C. a 可能小于b D. a 一定大于b
难度: 简单查看答案及解析
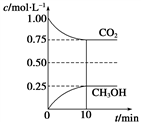
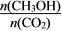 增大的是______(填编号)。
增大的是______(填编号)。