-
(15分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
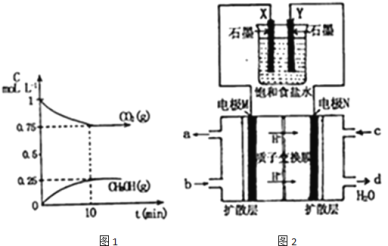
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
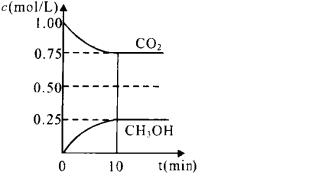
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
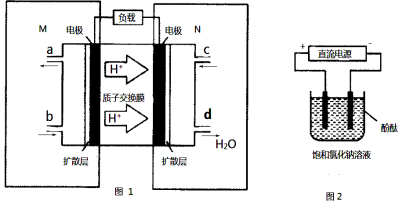
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
-
(14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
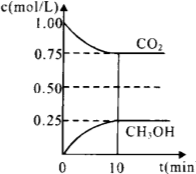
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
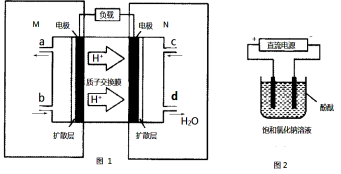
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
-
(14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
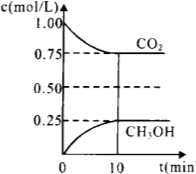
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
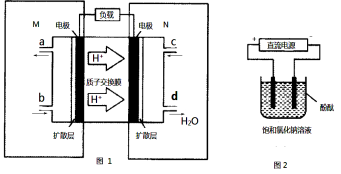
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
-
(15分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
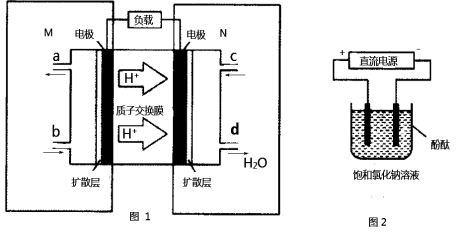
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
②CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
④H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
-
(16分)二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
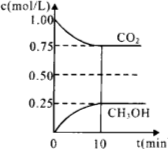
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。
 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
 C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。
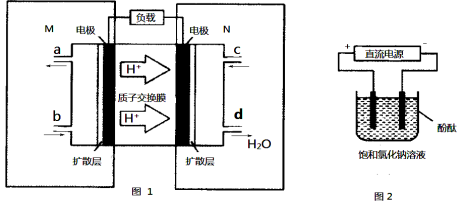
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
-
二氧化碳是引起“温室效应”的主要物质。高效利用能源,能够减少二氧化碳的排放。
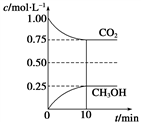
I.在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①不能说明该反应已达平衡状态的是__________。(填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2 mol H2,同时消耗0.4 mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②从0 min到10 min,v(H2)=______________________。
③下列措施中不能使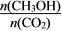 增大的是______(填编号)。
增大的是______(填编号)。
A.降低温度 B.将H2O(g)从体系中分离
C.恒温恒容下充入He(g) D.恒温恒容再充入2 mol CO2和3 mol H2
④计算该温度下此反应的平衡常数K=_____________________(保留两位有效数字)。
II.为进一步探究CO2与NaCN溶液反应的产物,查得数据如下:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________(可用分数表示)。
向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:_____________________。
III.(1)有一种利用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ===CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-b kJ·mol-1;
2H2(g)+O2(g)===2H2O(l) ΔH=-c kJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为____________________________________。
(2)某甲醇燃料电池原理如图所示。
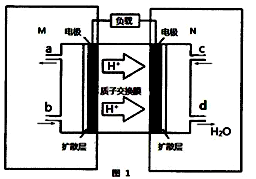
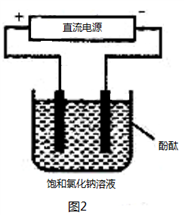
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用如图装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL(体积变化忽略),当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为_______g。
-
 是引起“温室效应”的主要物质,节能减排,高效利用化石能源,控制
是引起“温室效应”的主要物质,节能减排,高效利用化石能源,控制 排放,探索
排放,探索 的循环利用是保护环境,促进经济科持续发展的重要举措.
的循环利用是保护环境,促进经济科持续发展的重要举措.
(1)在一定温度下,向2L固定容积的密闭容器中通入2mol  ,3mol
,3mol  ,发生反应为:
,发生反应为: ,测得
,测得 和
和 的浓度随时间变化如图1所示.
的浓度随时间变化如图1所示.
①能说明该反应已达到平衡状态的是 ______
A. 体积分数在混合气体中保持不变
体积分数在混合气体中保持不变
B.单位时间内有
 断裂,同时有
断裂,同时有
 键生成
键生成
C.混合气体的密度不随时间变化
D.当体系中 :
: :l,且保持不变
:l,且保持不变
②下列措施能使 增大的是 ______
增大的是 ______
A.升高温度  恒温恒容充入
恒温恒容充入
 使
使 变成
变成
D.恒温恒容下,再充入2mol  ,3mol
,3mol 
③计算该温度下此反应的平衡常数 ______ ;若使
______ ;若使 应采取的措施是 ______
应采取的措施是 ______
A.增大压强 恒压加入一定量
恒压加入一定量 C.恒容通入
C.恒容通入 D.降低温度
D.降低温度 升高温度
升高温度
(2)如图2所示:用某甲醇燃料电池作电源电解饱和食盐水.
①写出电极N发生的反应式: ______
②若食盐水体积为300Ml,电解过程溶液体积变化忽略不计,常温下测得 时,理论上消耗甲醇质量为 ______
时,理论上消耗甲醇质量为 ______ 
-
(16分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
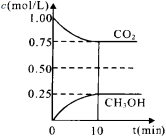
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。
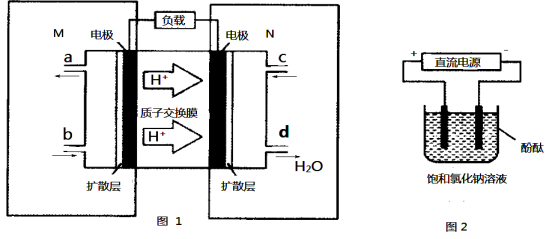
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
-
二氧化碳是引起“温室效应”的主要物质,对其有效的回收利用,不仅能缓解能源危机,又可减少温室效应的影响,具有解决能源问题和环保问题的双重意义。
(1) 和
和 经过催化重整可以得到合成气(
经过催化重整可以得到合成气( 和
和 );
);

①一定温度和压强下,由元素最稳定的单质生成 纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知
纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知 、
、 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为 、
、 、
、 。则上述重整反应的
。则上述重整反应的 ________
________ 。
。
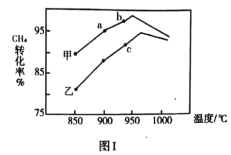
②其他条件相同,甲、乙两种不同催化剂作用下,相同时间内测得 转化率
转化率 与温度变化关系如图Ⅰ,
与温度变化关系如图Ⅰ, ________(填“可能一定”或“一定未”)达到平衡状态理由是________。
________(填“可能一定”或“一定未”)达到平衡状态理由是________。
(2) 与
与 可以用来生产尿素
可以用来生产尿素 ,其反应过程为:
,其反应过程为: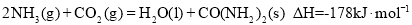 ;
;
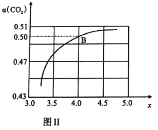
① 时,在
时,在 的密闭容器中充人
的密闭容器中充人 和
和 模拟工业生产。投料比
模拟工业生产。投料比 ,如图Ⅱ是
,如图Ⅱ是 平衡转化率
平衡转化率 与
与 的关系。则图中
的关系。则图中 点
点 的平衡转化率
的平衡转化率 _______。
_______。
②当 时,若起始的压强为
时,若起始的压强为 ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数 ________
________ 。
。
(3)以二氧化钛表面覆盖 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
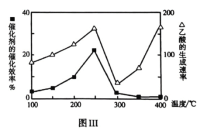
①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。250-300℃时,温度升高而乙酸的生成速率降低的原因是________。
②为了提高该反应中 的转化率,可以采取的措施是________。
的转化率,可以采取的措施是________。
(4)纳米二氧化钛膜中的 电对吸附
电对吸附 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入 进行电解,在阴极可制得低密度聚乙烯
进行电解,在阴极可制得低密度聚乙烯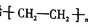 ,(简称
,(简称 )。电解时,
)。电解时, 最终转化为
最终转化为 的电极反应式是________。
的电极反应式是________。
-
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有_______molFeO被氧化。
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式___________。
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)  CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是_____________。
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度________(填字母)。
A.c(CH4)=0.8mol·L-1 B.0.8mol • L-1 >c(CH4) >1.6mol • L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol • L-1
(5)在300℃时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正_____v逆 (填“>” 或“<”)。
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H_________0(填“>”或“<”)。
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
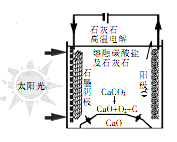
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为______________。

CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
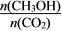 增大的是______(填编号)。
增大的是______(填编号)。











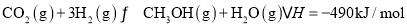 ,测得
,测得



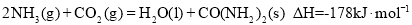 ;
;

 ,(简称
,(简称