-
化学与生产生话息息相关下列有关说法错误的是
A. 硅胶可用作食品的抗氧化剂 B. 可用热碱水清洗炊具上的油渍
C. 铁表面镀锌可增强其抗腐蚀性 D. 大量燃烧化石燃料是导致雾霾天气的重要因素之一
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 30gSiO2晶体中含有NA个硅氧键
B. 常温常压下,11.2LCl2含有的分子数目少于0.5NA
C. 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA
D. 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA
难度: 中等查看答案及解析
-
分子式为C4H8ClBr的有机物共有(不含立体异构)
A. 15种 B. 14种 C. 13种 D. 12种
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。在适宜的条件下,A、B、C可以发生如图所示的反应。下列说法正确的是
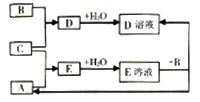
A. 化合物YX中含离子键 B. Z的含氧酸均为强酸
C. 非金属性:X>Z D. 离子半径:Y>Z
难度: 困难查看答案及解析
-
下列实验能达到相应目的的是
A. 用乙醇萃取溴水中的溴单质
B. 用干燥的pH试纸测定新制氯水的pH
C. 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应
D. 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体
难度: 中等查看答案及解析
-
下图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是
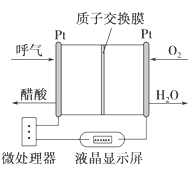
A. 电流由呼气所在的铂电极流出
B. H+透过质子交换膜流向氧气所在的铂电极
C. 电路中流过2mol电子时,消耗11.2LO2
D. 该电池的负极反应为:CH3CH2OH+3H2O-12e-=2CO2↑+12H+
难度: 困难查看答案及解析
-
常温下,下列有关电解质溶液的说法正确的是
A. pH=2的H2SO4与pH=12的NaOH等体积混合,所得溶液呈酸性
B. 0.1mol/L的CH3COOH溶液再加水稀释过程中
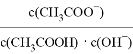 减小
减小C. pH=5的NaHSO3溶液中水的电离程度小于纯水的电离程度
D. 0.1mol/L的NaHCO3溶液中:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-)
难度: 困难查看答案及解析
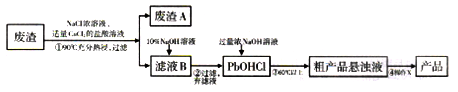
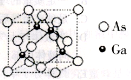
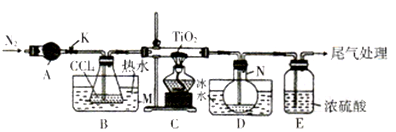
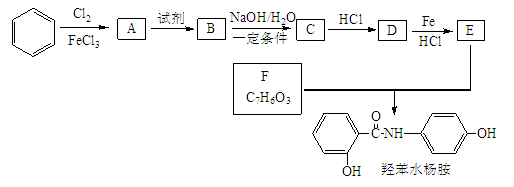
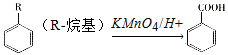 ;
;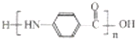 的合成路线______。
的合成路线______。