-
下列措施不符合节能减排的是
A.大力发展火力发电,解决城市电力紧张问题
B.在屋顶安装太阳能热水器,为居民提供生活用热水
C.尽量少开私家车,多骑自行车。
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 中等查看答案及解析
-
正丁烷和异丁烷互为同分异构体的依据是( )
A.具有相同的分子式 B.具有相似的化学性质
C.具有不同的物理性质 D.分子式相同,但分子内碳原子的连接方式不同
难度: 中等查看答案及解析
-
下列有关离子键、共价键的叙述中正确的是( )
A.离子化合物中只存在离子键,没有共价键
B.构成单质分子的粒子中一定含有共价键
C.共价化合物分子中一定不存在离子键
D.仅由非金属元素组成的化合物中一定不含离子键
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.盐酸与碳酸钡反应: CO32-+2H+=CO2↑+H2O
B.向硫酸铜溶液中滴加氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C.向硝酸银溶液中加入铜粉: Ag++Cu=Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列化学式表示物质分子的是( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2) C.白磷(P4) D.硫酸钠(Na2SO4)
难度: 中等查看答案及解析
-
下列各组物质的晶体中化学键类型相同,晶体类型也相同的是
A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.NaOH和CCl4
难度: 中等查看答案及解析
-
鉴别稀硫酸和浓硫酸最简单的方法是( )
A.加酚酞试液 B.与铜片反应
C.加BaCl2溶液和硝酸 D.用玻璃棒各蘸一点滴在纸上
难度: 中等查看答案及解析
-
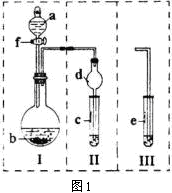
利用以下装置能实现预想的是( )
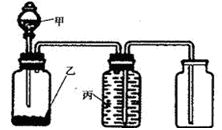
难度: 中等查看答案及解析
-
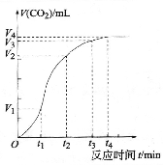
已知在2L密闭容器内,发生:2NO(g)+O2(g)⇌2 NO 2(g),不能说明该反应已达到平衡状态的是( )
A.容器内颜色保持不变 B.v逆(NO)=2v正(O2)
C.单位时间内生成amol的O2,同时生成2amolNO2 D.容器内密度保持不变
难度: 中等查看答案及解析
-
下列物质性质比较正确的是( )
A.热稳定性:HCl>H2S>H2O B.离子半径:Na+>Cl->F-
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.熔点:金刚石>干冰>食盐
难度: 中等查看答案及解析
-
下列过程需要克服分子间作用力的是( )
A.HCl气体溶于水 B.液氯汽化
C.氯化镁受热熔化 D.二氧化硅受热熔化
难度: 中等查看答案及解析
-
如图为元素周期表中短周期的一部分,其中b原子的最外层电子数为电子层数的两倍,则下列叙述中正确的是( )
A.b的元素符号为C B.a元素的最高正化合价为+6
C.c元素的最高正化合价为+5 D.b元素的气态氢化物的化学式为H2S
难度: 中等查看答案及解析
-
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.XeF4 C.CCl4 D.SO2
难度: 简单查看答案及解析
-
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是( )
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色
难度: 中等查看答案及解析
-
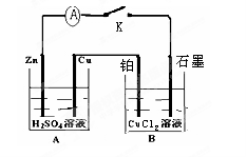
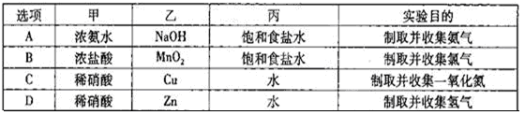
下列装置能构成原电池的是( )
难度: 简单查看答案及解析
-
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
A.H2和Cl2 B.Cu和Cl2 C. H2和O2 D.Cu和O2
难度: 中等查看答案及解析
-
下图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )

A.a电极是负极
B.b电极的电极反应式为4OH--4e-=2H2O+O2↑
C.在电池内部,H+向b电极附近运动
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源
难度: 中等查看答案及解析
-
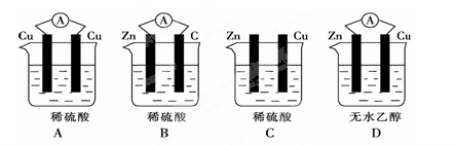
已知Zn+Cu2+=Cu+Zn2+,能实现该反应的原电池的正确组成是( )
A
B
C
D
正极
Zn
Cu
Zn
Fe
负极
Cu
Zn
Ag
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
CuCl2
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热 B.用98%的浓硫酸代替稀硫酸
C.滴加少量硫酸铜溶液 D.若用铁片改用铁粉
难度: 中等查看答案及解析
-
已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436 kJ、243 kJ、432 kJ能量,则由H2与Cl2生成1 mol HCl总的过程需要( )
A.放热185 kJ B.吸热185 kJ C.放热92.5 kJ D.吸热92.5 kJ
难度: 中等查看答案及解析
-
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
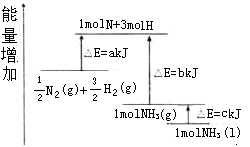
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C.
N2(g)+
H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
D.
N2(g)+
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
难度: 中等查看答案及解析
-
在Al与稀H2SO4的反应中,已知10 s末H2SO4的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成Al2 (SO4)3的平均反应速率为( )
A.0.02 mol·L-1·s-1 B.0.04 mol·L-1·s-1 C.0.06 mol·L-1·s-1 D.0.18 mol·L-1·s-1
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图。则下列表述中正确的是( )
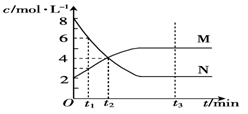
A.该反应的化学方程式为2N ⇌ M
B.t1时,M的浓度是N浓度的2倍
C.t3时,正反应速率大于逆反应速率
D.t2时,正、逆反应速率相等,化学反应达到了平衡
难度: 中等查看答案及解析
-
在100 mL某混合酸中,c(HNO3)=0.4 mol·L-1,c(H2SO4)=0.1 mol·L-1,向其中加入1.92 g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
A.0.15 mol·L-1 B.0.30 mol·L-1 C.0.225 mol·L-1 D.无法计算
难度: 中等查看答案及解析