-
下列关于有机物的叙述中,错误的是( )
A.聚氯乙烯材质的塑料袋不能直接用于包装熟食
B.碳原子之间可以形成单键、双键和三键,还可以形成环状结构
C.蛋白质溶液中加入浓的硫酸铵溶液会有蛋白质析出
D.糖类、油脂和蛋白质在一定条件下都能发生水解反应难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.硅的化学性质不活泼,在自然界中主要以游离态存在
B.丁达尔效应可用于区别溶液、胶体和悬浊液
C.Na2O和Na2O2都能与稀硫酸反应,但化学键种类不完全相同
D.日本福岛核电站爆炸时释放的2种放射性核素53131I与55137Cs属于同位素难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1molCH3+含有9NA个电子
B.lmolNaHSO4固体中含有阳离子的数目为2NA
C.常温常压下,22.4L乙烯中含C-H键的数目小于4NA
D.H2O2分解生成1mol氧气时有4NA个电子发生转移难度: 中等查看答案及解析
-
为研究H2O2酶对反应2H2O2=2H2O+O2↑的影响,通过实验可得到如下两个曲线.图甲是室温下H2O2酶的活性受pH影响的曲线,图乙表示在最合适温度及pH=b条件下H2O2分解产生的O2的体积随时间的变化.若反应过程中改变某一初始条件(其他条件不变),以下叙述正确的是( )

A.温度升至100℃,e点不移,d点右移
B.H2O2用量增加时,e点不移,d点左移
C.pH=c时,e点为0
D.pH=a时,e点下移,d点左移难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用铂电极电解氯化镁溶液:2Cl-+2H2OH2↑+Cl2↑+2OH-
B.向NaHS溶液中通入少量氯气:HS-+Cl2=S↓+H++2Cl-
C.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑难度: 中等查看答案及解析
-
常温下0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列正确是( )
A.该溶液中由水电离出的c(H+)=1×10-11mol•L-1
B.浓度均为0.1mol•L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则有:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1mol•L-1HA溶液与0.05mol•L-1NaOH溶液等体积混合后所得溶液中:c(A-)+c(HA)=c(Na+)
D.0.1mol•L-1HA溶液与0.05mol•L-1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)=c(OH-)难度: 中等查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g);△H=-92.6kJ•mol-1,实验测得反应起始时、达到平衡状态时的有关数据如下表所示,不正确的是( )
容器
编号起始时各物质物质的量/mol 平衡时体系能量的变化 X2 Y2 XY3 ① 1 3 放热Q1=23.15kJ ② 0.6 1.8 0.8 Q2
A.达平衡时,两个容器中XY3的物质的量浓度均为2mol•L-1
B.容器①、②中反应的平衡常数相等
C.容器②中反应达到平衡状态时放出23.15×kJ的热量
D.若容器①体积为0.20L,则反应达到平衡状态时放出的热量大于23.15kJ难度: 中等查看答案及解析


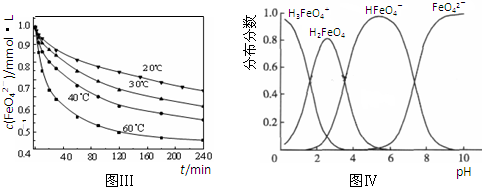

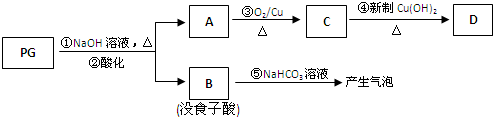
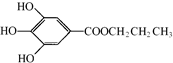 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.