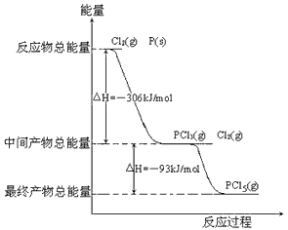
-
下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)
H2O(l) ΔH =-57.3 kJ·mol -1,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ
D.1mol S完全燃烧放热297.3 kJ,热化学方程式为:S+O2
SO2 ΔH=-297.3 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.强酸跟强碱的反应热一定是中和热
B.1molC完全燃烧放热383.3kJ,其热化学方程为:
C+O2=CO2 ΔH=-383.3kJ·mol-1
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D.表示中和热的离子方程式为:
H+(aq)+OH-(aq)
H2O(l);ΔH=57.3KJ·mol-1
难度: 中等查看答案及解析
-
在298K、100kPa时,已知:(1)2H2O(g)
O2(g)+2H2(g) ΔH1
(2)Cl2(g)+H2(g)=2HCl(g) ΔH2
(3)2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
工业生产水煤气的反应为:C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)
C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
难度: 中等查看答案及解析
-
已知化学方程式:2SO2(g)+O2(g)=2SO3(g) ΔH=-QkJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2 (g)和1mol O2(g)所具有的总能量低于2molSO3(g)所具有的能量
B.将2 mol SO2 (g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2mol SO2(g)被氧化
难度: 中等查看答案及解析
-
1 molCH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519kJ。如果1 molCH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25kJ的热量,则一定量O2的质量为
A.40g B.56g C.60g D.无法计算
难度: 中等查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
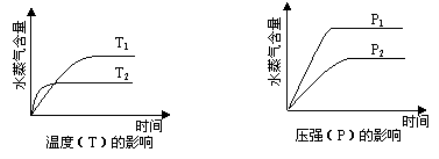
A.CO2(g) + 2NH3(g)=CO(NH2)2(s) + H2O(g) ΔH<0
B. CO2(g) + H2(g)=CO(g) + H2O(g) ΔH>0
C.CH3CH2OH(g)=CH2=CH2(g) + H2O(g) ΔH>0
D.2C6H5CH2CH3(g) + O2(g)=2C6H5CH=CH2(g) + 2H2O(g) ΔH<0
难度: 中等查看答案及解析
-
①C(s)+O2(g)
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
难度: 中等查看答案及解析
-
已知:P4(g)+6Cl2(g
4PCl3(g)ΔH=
kJ·mol-1,P4(g)+10Cl2(g)
4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P-C1键的键能为c kJ·mol-1,PCl3中P-C1键的键能为1.2c kJ·mol-1。
下列叙述正确的是
A.P-P键的键能大于P-C1键的键能
B.可求Cl2(g)+PCl3(g)
PCl5(s)的反应热ΔH
C.C1-C1键的键能为(b-
+5.6c)/4kJ·mol-1
D.P-P键的键能为(5
-3b+12c)/8kJ·mol-1
难度: 困难查看答案及解析
-
你认为不正确的是
A.化学反应速率理念可指导怎样在一定时间内快出产品
B.化学平衡理念可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.用速率理论和平衡理论都可提高化工生产的综合经济效益
难度: 简单查看答案及解析
-
将4molA和2molB在2L密闭容器中混合发生反应,2A(g)+B(g)
2C(g);ΔH<0,4秒后反应达到平衡状态,此时得C的浓度为0.6mol/L,下列说法正确的是
A.当A、B、C物质的量浓度化为2︰1︰2时,反应即达到平衡状态
B.4S内用物质B表示的反应速率为0.075mol/(L·S)
C.达平衡后通入一定量的氦气,A的转化率降低
D.达平衡后升高温度,C的浓度将增大
难度: 中等查看答案及解析
-
工业制A1,你认为说法不妥当的是
A.铝便于运输、贮存,从安全角度考虑,铝是最佳燃料之一
B.铝资源比较丰富,易于开采,且可以再生
C.铝燃烧热大,燃烧污染小,易有效控制
D.寻找高效催化剂,使A12O3分解同时释放能量,是铝能源大规模开发利用的一项关键技术
难度: 简单查看答案及解析
-
已知可逆反应
中,A、C的含量随温度的变化曲线如图所示,下列说法正确的是
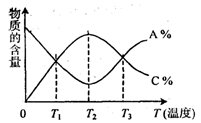
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的正反应是吸热反应
D.升高温度,平衡会向正反应方向移动
难度: 中等查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 molA、0.75molB 、1.5molC,平衡向正反应方向移动
D.乙中的热化学反应方程式为2C(g)
aA(g)+3B(g);ΔH=+Q2kJ·mol-1
难度: 中等查看答案及解析
-
以NA代表阿伏加德罗常数,有关反应:C2H2(g)+
O2(g)→2CO2(g)+H2O(1);ΔH=-1300kJ/mol。下列关于热化学方程式的说法正确的是
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,吸收1300kJ的能量
难度: 中等查看答案及解析
-
相同温度下,两个恒压密闭容器中发生可逆反应X2(g)+3Y2(g)
2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
容器编号
起始时各物质物质的量/mol
达平衡时体系能量变化
X2
Y2
XY3
①
0.1
0.3
0
4.63kJ
②
0.8
2.4
0.4
Q(Q>0)kJ
下列叙述正确的是
A.反应的平衡常数:①>②
B.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C.达到平衡时,容器①、②中各物质的百分含量相同
D.若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ
难度: 困难查看答案及解析
 ,请画出N4H44+的结构式
,请画出N4H44+的结构式