-
下列说法正确的是( )
A.酿酒过程中,葡萄糖可通过水解反应生成酒精
B.鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解
C.酸性高锰酸钾紫色溶液中加入植物油充分振荡后,溶液颜色会褪去
D.维生素C(
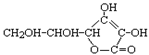 )溶液中滴加KI淀粉溶液,立即变蓝色
)溶液中滴加KI淀粉溶液,立即变蓝色难度: 中等查看答案及解析
-
下列说法正确的 ( )
A.1mol乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023
B.等物质的量的—CH3与OH-所含电子数相等
C.7.8g Na2O2中所含阴离子的物质的量是0.2mol
D.35C12和37C12互为同素异形体
难度: 中等查看答案及解析
-
下列离子在给定的条件下一定能大量共存的是c(Fe3+)=0.1mol/L的溶液中:( )
A.加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3-
B.含有SCN—离子的溶液中:Ca2+、Fe2+、NO3-、Cl-
C.水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl-
D.NH4+、Cl-、AlO2-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式的书写与结论均合理的是( )
选项
离子方程式
结论
A
AgCl(s)+I-(aq)
AgI(s)+Cl-(aq)
溶解度:AgI>AgCl
B
Fe2++H2O2+2H+===Fe3++2H2O
氧化性:H2O2>Fe3+
C
CO32-+CO2+H2O===2HCO3-
稳定性:HCO3->CO32-
D
NH3+H3O+===NH4++H2O
得质子能力:NH3>H2O
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
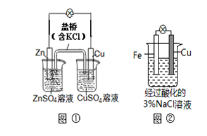
A.图①中正极附近溶液pH降低
B.图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液
C.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
D.图②正极反应是O2+2H2O+4e¯=4OH¯
难度: 中等查看答案及解析
-
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.
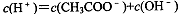
B.加入少量CH3COONa固体后,c(CH3COO¯)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH=11的NaOH溶液混合后所得溶液显酸性
难度: 中等查看答案及解析