-
升高温度能加快化学反应速率的主要原因是
A. 增加活化分子百分数 B. 降低活化分子的能量
C. 活化分子能量明显增加 D. 降低反应所需的能量
难度: 中等查看答案及解析
-
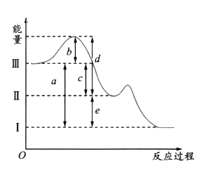
下列关于反应能量的说法正确的是
A. 由C(石墨)═C(金刚石)△H=+1.90 kJ•mol﹣1可知,金刚石比石墨稳定
B. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2
C. 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同
D. 化学反应除了生成新的物质外,还伴随着能量的变化
难度: 中等查看答案及解析
-
下列措施能明显增大原反应的化学反应速率的是
A. Na与水反应时增大水的用量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温、恒容条件下,在工业合成氨反应中,增加氮气的量
难度: 中等查看答案及解析
-
一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色不一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,达到平衡后, 体系颜色加深
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g) == H2(g) +1/2 O2(g) △H = +241.8 kJ·mol-1
H2(g)+ 1/2O2(g) == H2O(1) △H = -285.8 kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是
A. 吸热88kJ B. 吸热2.44 kJ C. 放热2.44 kJ D. 吸热44 kJ
难度: 中等查看答案及解析
-
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A. 氢气的燃烧热为△H=-akJ·mol-1
B. c<d
C. 一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D. 0.5a>b
难度: 中等查看答案及解析
-
已知反应 2NH3
N2 + 3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2
NH3的平衡常数为
A. 4 B. 2 C. 1 D. 0.5
难度: 简单查看答案及解析
-
1 mol化学键变为气态原子所需的能量用E表示。结合表中信息判断下列说法不正确的是
共价键
H-H
F-F
H-F
H-Cl
H-I
E(kJ·mol-1)
436
157
568
432
298
A. 432 kJ·mol-1>E(H-Br)>298 kJ·mol-1
B. 表中最稳定的共价键是H—F键
C. H2(g)→2H (g) ΔH=+436 kJ·mol-1
D. H2(g)+F2(g)=2HF(g) ∆H=+25 kJ·mol-1
难度: 中等查看答案及解析
-
当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是
①N2(g)+3H2(g)===2NH3(g) ΔH=-92.48 kJ/mol
②N2(g)+3H2(g)===2NH3(g) ΔH=-46.24kJ/mol
③NH3(g)===1/2N2(g)+3/2H2(g) ΔH=+46.24 kJ/mol
④2NH3(g)===N2(g)+3H2(g) ΔH=-92.48 kJ/mol
A. ① ③ B. ② ④ C. ② ③ D. ① ④
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
对于平衡体系:aA(g)+bB(g)
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B. 若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为 a:b
C. 若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D. 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变
难度: 困难查看答案及解析
-
对于可逆反应mA(g)十nB(g)
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
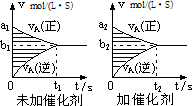
A.b1>b2 ,t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(II)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
难度: 中等查看答案及解析
-
把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
A. 5min内P的平均反应速率为0.15mol/(L·min)
B. Q的平衡浓度为1mol/L
C. Q的转化率为25%
D. x是2
难度: 极难查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
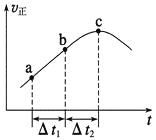
A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
难度: 简单查看答案及解析
-
加热N2O5依次发生的分解反应为:
①N2O5(g)
N2O3(g)+O2(g)
②N2O3(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
A. 1.8mol/L B. 0.9 mol/L C. 2.3 mol/L D. 4.0 mol/L
难度: 困难查看答案及解析
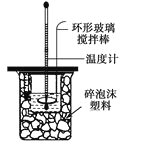
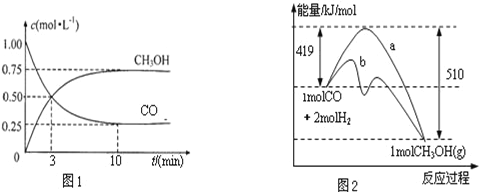
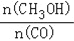 增大的有__________;
增大的有__________;