-
生活中处处有化学,下列表述不正确的是
A.福尔马林可作食品的保鲜剂
B.聚乙烯塑料制品可用于食品的包装
C.碳酸氢钠可作胃酸的中和剂
D.食盐可作调味剂,也可作食品防腐剂
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.0.1mol
OD- 离子含有的质子、中子数均为1.0NA
B.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA
C.3.6 g石墨中,含有共价键数为0.3NA
D.标准状况下,4.48 L己烷含有的分子数为0.2NA
难度: 中等查看答案及解析
-
已知废旧干电池中的填充物主要有二氧化锰、炭黑、氯化锌、氯化铵、淀粉糊、Mn2O3、ZnO、FeO、汞的化合物等。某实验小组的同学拟回收废旧电池中的部份物质,主要操作流程如下图:
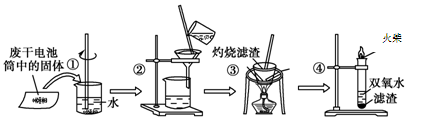
下列说法不正确的是
A. 步骤①②的名称分别为溶解、过滤
B. 步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒
C. 步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同
D. 步骤④的离子方程式为2Fe2++2H++H2O2 = 2Fe3++2H2O
难度: 困难查看答案及解析
-
下列判断正确的是
A.通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32-
B.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同
C.NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++ Al3++5OH-=NH3·H2O+ AlO2-+2H2O
D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性
难度: 中等查看答案及解析
-
某种药物合成中间体的结构简式为:
,有关该物质的说法不正确的是
A.属于芳香族化合物
B.能发生消去反应和酯化反应
C.能分别与金属Na、NaHCO3溶液反应
D.1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH
难度: 中等查看答案及解析
-
25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH
HClO
H2CO3
K(CH3COOH)
=1.8×10-5
K(HClO)
=3.0×10-8
K(H2CO3)a1=4.4×10-7
K(H2CO3)a2=4.7×10-11
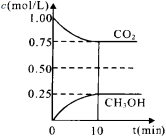
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
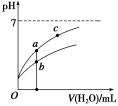
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.图像中a、c两点所处的溶液中
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
难度: 极难查看答案及解析
-
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g)
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s
0
50
150
250
350
n(B)/mol
0
0.16
0.19
0.20
0.20
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
难度: 困难查看答案及解析