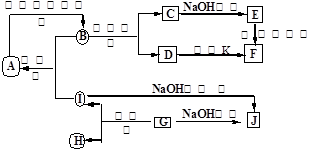-
(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g) 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为________;该条件下反应的平衡常数K=________(精确到小数点后两位)
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
再通入1.6molSO2、0.8molO2、0.4molSO3,________;再通入0.2molSO2、0.2molSO3,_____
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 ______ 。
-
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
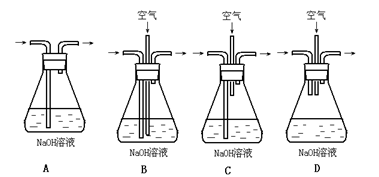
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:________;为了吸收该反应中产生的尾气,请选择下列中合适的装置________。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是________。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是________。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因________。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是________,
⑥本实验CuSO4·5H2O的产率为________。
-
I. A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
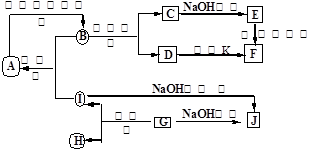
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置________,
(2)写出反应④的离子方程式________。
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的
pH________7 (填“>”、“<”或“=”),用离子方程式表示其原因:________ 。
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
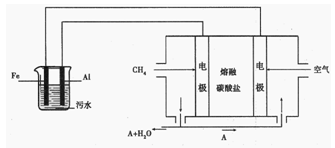
(1)电解池阳极的电极反应分别是
①; ② 。
。
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 。
。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是________。
(3)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________ L。
-
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式为:________;________。
(2)生产过程中B和D的操作名称分别是和________(B和D均为简单操作)。
(3)反应中副产品a是________。
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用________。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
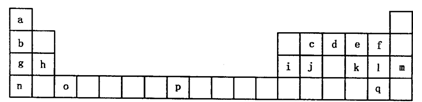
试回答下列问题:
(1)请写出元素o的基态原子电子排布式________,g元素的价电子的四个量子数依次是________。
(2)d的氢化物中心原子的杂化方式是________。
(3)o元素所在族的符号是________。
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是________。
(5)f、l、q的氢化物中沸点最高的是________。(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点________jc晶体的熔点(填“大于”“等于”“小于”)原因是________
-
菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,

其的合成路线如下:

提示: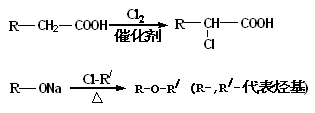
(1)有机物乙中所含有的官能团是_________
(2)上述合成菠萝酯的过程中,下列反应类型中未涉及到的是___________。
A.取代反应 B.加成反应 C.消去反应 D.中和反应
(3)菠萝酯有多种同分异构体,写出同时满足下列三个条件的同分异构体的结构简式。(写出其中的一种即可)
①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色
②除苯环外无其他环状基团
③能与NaOH溶液反应,且1mol该同分异构体最多能与2molNaOH反应___________
(4)写出由丙→菠萝酯的化学化学方程式。______________________。
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是