-
生活中的一些问题常涉及到化学知识,则下列叙述正确的是 ( )
A.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
B.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应
D.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.室温下,14.0g分子通式为CnH2n烯烃中含有的碳碳双键数目为NA/n
C.标准状况下,5.6 L O2与适量Na加热反应,转移的电子数一定为NA
D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
难度: 中等查看答案及解析
-
有关下列四个常用电化学装置的叙述中正确的是( )
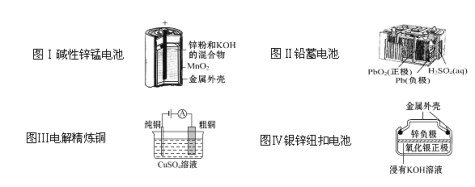
A.图Ⅰ所示电池中,负极电极反应为Zn-2e-
Zn2+
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+
Fe2++2H2O
C.将铝片加入烧碱溶液中:2Al+2OH-+2H2O
2AlO2-+3H2↑
D.氯化铝溶液中加入过量氨水反应实质是Al3++4NH3·H2O===AlO2-+4NH
难度: 中等查看答案及解析
-
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积相等时具有的电子数相等
B.原子数相等时具有的中子数相等
C.体积相等时密度相等
D.质量相等时具有的质子数相等
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是 ( )
A.苯和乙烯都能使溴水褪色,且反应原理相同
B.乙炔和苯均为不饱和烃,都只能发生加成反应
C.分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种
D.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
难度: 简单查看答案及解析
-
X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y 元素的+3价阳离子的核外电子排布与氖原子相同,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.气态氢化物的稳定性:X<Z<W
B.X、Z、W氧化物对应水化物酸性的强弱顺序为X<Z<W
C.Y的阳离子半径比W的阴离子半径小
D.室温下,含Y元素的盐形成的水溶液其pH<7
难度: 简单查看答案及解析