-
下列说法中正确的是 ( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
难度: 中等查看答案及解析
-
下列有关能量转换的说法正确的是 ( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.直径介于1nm~10nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
难度: 中等查看答案及解析
-
以下实验或操作不能达到目的的是 ( )
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象
难度: 中等查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是 ( )
A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
难度: 中等查看答案及解析
-
xR2++yH++O2=mR3++nH2O的离子方程式,对m和R3+判断正确的是 ( )
A.m=4,R3+是氧化产物 B.m=y,R3+是氧化产物
C.m=2,R3+是还原产物 D.m=y/2,R3+是还原产物
难度: 中等查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C 高温 2 AlN + 3CO ,下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为—3
D.氮化铝晶体属于分子晶体
难度: 中等查看答案及解析
-
石墨能与熔融的金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式为CxK,其平面图形见图,则x的值为( )
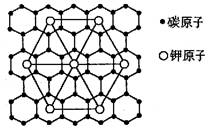
A.8 B.12 C.24 D.60
难度: 中等查看答案及解析
-
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是( )
A.Fe3+、F-、Cl- B.Mg2+、SO
、Br-
C.Mg2+、Cl-、Fe2+ D.Na+、NH
、Cu2+
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是 ( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
难度: 中等查看答案及解析
-
在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ( )
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性
难度: 中等查看答案及解析
-
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有 ( )
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+
O2(g)=H2O(l);△H=-Q2kJ·mol-1
A.①② B.③④ C.②④ D.①③
难度: 中等查看答案及解析
-
已知反应:
①25℃、101kPa时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是 ( )
A.N2H4的燃烧热大于534 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能/kJ·mol-1
460
360
436
431
176
347
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
难度: 中等查看答案及解析
-
锰的氧化物MnO2、Mn2O3、Mn3O4,Mn2O7在加热时均能和浓盐酸反应生成MnCl2和Cl2。现11.45 g锰的某种氧化物跟足量的盐酸反应,产生的氯气在标准状况下的体积为1.12 L,则参加反应的氧化物是( )
A.MnO2 B.Mn2O3 C.Mn3O4 D.Mn2O7
难度: 中等查看答案及解析
