-
化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是
A.以地沟油为原料加工制成的生物柴油成分与从石油分馏得到的柴油成分不同
B.
在食品袋中放入
盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
难度: 中等查看答案及解析
-
新修订的《环境空气质量标准》增设了PM2.5浓度限值和臭氧8小时平均浓度限值等.PM2.5是指空气中直径为2.5×10﹣6m的固体颗粒或液滴的总称.下列说法错误的是
A.PM2.5分散在空气中可形成胶体
B.高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障
C.低空的臭氧是污染气体,会给人体造成伤害
D.化石类燃料的燃烧、含硫矿石的冶炼等过程都是造成SO2污染的重要原因
难度: 中等查看答案及解析
-
短周期元素 X、Y、Z、W,它们的原子序数依次增大。X 与 Z 同主族,并且原子序数 之和为 20。Y 原子的质子数为 Z 原子的质子数的一半,W 原子的最外层电子数比 Y原子的最外层电子数多 2 个。下列叙述正确的是
A.Y 的最高价氧化物对应的水化物可与其气态氢化物发生化合反应
B.原子半径Z>W>Y>X
C.气态氢化物的稳定性 Z>W
D.X 的气态氢化物与足量 W 单质在光照条件下反应生成物均为气体
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2═2Fe3++2Cl﹣
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I﹣═2I2+2H2O
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
D.碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3﹣+2Ca2++4OH﹣═Mg(OH)2↓+2CaCO3↓+2H2O
难度: 中等查看答案及解析
-
下列各项操作中,能发生“先沉淀后溶解”现象的是
①向BaCl2溶液中通入过量的SO2
②向Fe(OH)3胶体中逐滴滴入过量稀H2SO4
③向Na[Al(OH)4]溶液中逐滴加入过量的AlCl3溶液
④向澄清石灰水中通入过量的SO2
⑤向硅酸钠溶液中通入过量的CO2
⑥向AgNO3溶液中逐滴加入过量的氨水.
A.②④⑥ B.①②④ C.①③⑤⑥ D.②③④⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是
A.25℃时,pH=13的氨水中含有OH﹣的数目为0.1NA
B. 标准状况下,2.24 LNO2 与水反应生成NO3﹣的数目为0.1NA
C. 1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D. 4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
难度: 中等查看答案及解析
-
在一定
温度下的定容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
A.①②③ B.③④⑥ C.②③⑤⑥ D.只有 ③
难度: 中等查看答案及解析
-
少量铁片与l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
A.①⑥⑦ B.③⑤⑧
C.③⑦⑧ D.③④⑥⑦⑧
难度: 中等查看答案及解析
-
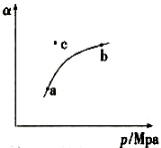
合成氨反应:N2(g)+3H2(g)
2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图所示:
下列说法正确的是
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
难度: 中等查看答案及解析
-
某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g)
CO(g)+H2(g),②CO(g)+H2O(g)
CO2(g)+H2(g)反应达到平衡时,c(H2)=1.9mol•L﹣1、c(CO)=0.1mol•L﹣1.则下列叙述正确的是
A.CO在平衡时转化率为10%
B.平衡浓度c(CO2)=c(H2)
C.其他条件不变时,缩小体积,反应②平衡不移动
D.平衡时增大碳的质量,反应①中热量值不变
难度: 困难查看答案及解析
-
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
△H=﹣1269kJ/mol
②

下列说法正确的是
A.断开1 mol O﹣O键比断开1 mol N﹣N键所需能量少448kJ
B.断开1 mol H﹣O键比断开1 mol H﹣N键所需能量相差约72.6kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知 H一O键比H一N键弱
难度: 中等查看答案及解析
-
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g)
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
A. 增大反应体系的压强,反应速率可能加快
B. 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C. 电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D. 将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝
难度: 中等查看答案及解析
-
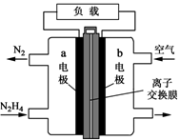
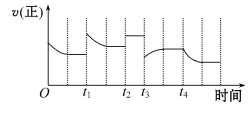
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是
A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e-
NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
难度: 困难查看答案及解析
-
下列说法不正确的是
①将CO2通入BaCl2溶液中,始终无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42﹣
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥滴有酚酞的Na2CO3溶液中,加BaC12溶液红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为SiO2能和CaCO3反应生成CO2,所以H2SiO3酸性强于H2CO3.
A. ②④⑥⑦ B. ①③④⑤ C. ③④⑤⑦ D. ②③④⑤⑦
难度: 中等查看答案及解析
-
(3分)下列说法不正确的是
A. 一定温度下,在固定体积的密闭容器中发生可逆反应A(s)+B(g)═C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
B. 对于反应C(s)+CO2(g)═2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
C. 常温下向0.1mol•L﹣1的NH3•H2O中加入氯化铵固体,则溶液中
减小
D. 常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液,溶液中
不变
难度: 困难查看答案及解析
-
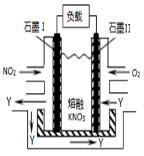
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是
A.温度: T1>T2>T3
B.正反应速率:υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
难度: 困难查看答案及解析
-
向某恒容密闭容器中充入一定量C02和H2,发生反应:
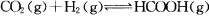 测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是
测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是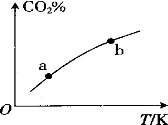
①:正反应速率 ②逆反应速率 ③HCOOH(g)的浓度 ④对应温度时的平衡常数
A. ①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g)
2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g)
TiCl4(g)+O2(g)”在一定条件
下可自发进行,则该反 应的ΔS<0
D.为处理锅炉水垢中的 CaSO4,可先用饱和 Na2CO3 溶液浸泡,再加盐酸溶解
难度: 中等查看答案及解析
-
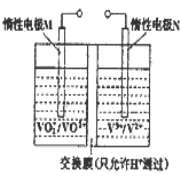
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
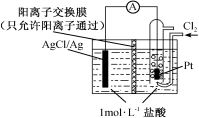
A.正极反应为AgCl+e-=Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 困难查看答案及解析
-
为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2
+H2O).现有由1mol NO、2mol NO2、1mol N2O4组成的混合气体恰好被1L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
A.3 mol/L B. 4 mol/L C. 5 mol/L D. 6 mol/L
难度: 困难查看答案及解析