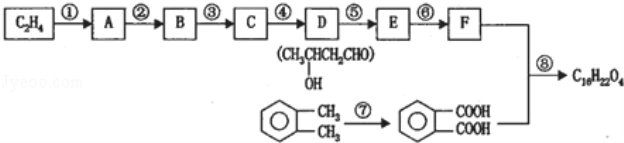
-
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
“嫦娥一号”发射火箭燃料
液氢(H2)
①2H2(g)+O2(g)
2H2O(l) ΔH=-571.6 kJ·mol-1
②2H2(l)+O2(l)
2H2O(g) ΔH=-482.6 kJ·mol-1
北京奥运会“祥云”火炬燃料
丙烷
(C3H8)
③C3H8(l)+5O2(g)
3CO2(g)+4H2O(g) ΔH=-2 013.8 kJ·mol-1
④C3H8(g)+5O2(g)
3CO2(g)+4H2O(l) ΔH=-2 221.5 kJ·mol-1
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
在25℃时,pH=1的两种酸溶液A、B各1 ml,分别加水稀释到1000ml,其pH与溶液体积V的关系如图所示,则下列说法不正确的是:

A.稀释后,A酸溶液的酸性比B酸溶液弱
B.稀释前,两种酸溶液的物质的量浓度一定相等
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
难度: 中等查看答案及解析
-
如图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
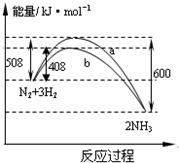
A.该反应的热化学方程式为:1/2N2(g)+3/2H2(g)
NH3(g) △H=-92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mo
l-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
难度: 中等查看答案及解析
-
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应2SO2(g)+ O2(g)
2SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
A.等于0.3mol B.等于0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
难度: 中等查看答案及解析
-
下列表述正确的是
A.100 ℃时,0.1 mol·L-1 HCl和NaOH溶液的pH分别为1和13
B.将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低
C.等体积、等pH的HCl和CH3 COOH溶液分别与NaOH溶液反应,CH3 COOH消耗NaOH的物质的量多
D.在滴有酚酞溶液的氨水中,加入NH4Cl(溶液显酸性)至溶液无色,此时溶液一定显中性
难度: 中等查看答案及解析
-
某温度下,在容积不变的密闭容器中存在下列可逆反应:A(g)+3B(g)
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
A.平衡不移动
B.平衡时C的物质的量增大
C.平衡向逆反应方向移动
D.平衡时混合气体的平均摩尔质量减少
难度: 中等查看答案及解析
-
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是

A. 该实验表明化学能可以转化为热能
B. 做该实验时环境温度为22 ℃
C. NaOH溶液的浓度约为1.00 mol·L-1
D. 该实验表明有水生成的反应都是放热反应
难度: 困难查看答案及解析
-
已知反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。

则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
难度: 困难查看答案及解析
-
下列说法中正确的是
A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行
B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行
C.反应方向是由焓变和熵变共同决定的,与反应温度无关
D.温度有可能对反应的方向起决定性作用
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g);△ H=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
气体积体L /c(Y):mol•L﹣1
温度℃
1
2
3
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
难度: 困难查看答案及解析
-
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能(已知键能跟原子半径有关,原子半径越大,形成的共价键键能越小)
B.可求Cl2(g)+ PCl3(g)=PCl5(s)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
难度: 困难查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是:
A.未加盐酸时:c(OH-) +c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时:
c(Cl-) =c(NH4+) +c(Na+)
难度: 中等查看答案及解析