-
(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
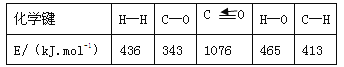
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
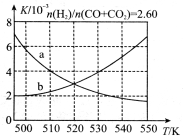
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
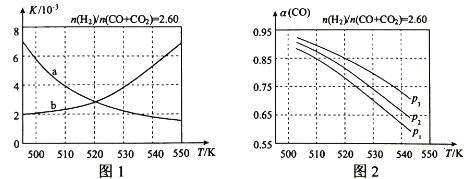
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
-
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1〈0
CH3OH(g) △H1〈0
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3〉0
CO(g)+H2O(g) △H3〉0
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0. 784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________。
-
(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。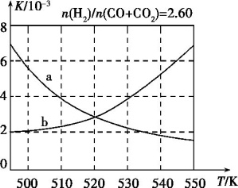
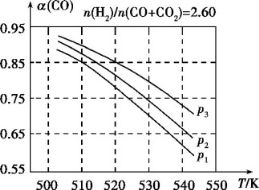
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。
-
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g);△H1
CH3OH(g);△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H2
CH3OH(g)+H2O(g);△H2
③CO2(g)+H2(g) CO(g)+H2O(g);△H3
CO(g)+H2O(g);△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | CO的键能 | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

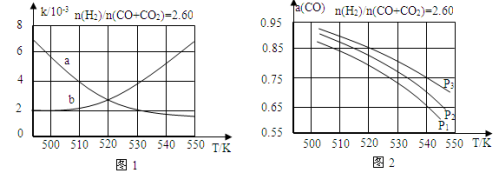
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_________________,其判断理由是 。
-
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=__________kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_________kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_______________;③的化学平衡常数K的表达式为_____________;
-
甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C  O O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
-
甲醇既是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 。下图中能正确反映该反应平衡常数K随温度变化关系的曲线为 (填“a”或“b”),其判断理由是 。
(2)合成气的组成 时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
(3)若在一定条件下,容积恒定为VL的反应室中充入amolCO与2amolH2,在催化剂作用下仅发生反应①,下列措施一定使c(CH3OH)/c(CO)增大的是 (填字母)。
A.升高温度 B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2 D.恒温恒容再充入a mol CO和2a mol H2
-
甲醇既是重要的化工原料,又可作为燃料,还可以作为燃料电池的原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=_____kJ·mol-1。
(2)已知:
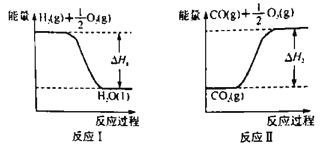
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)  CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
(3)以CH4和H2O为原料,通过下列反应也可以制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)= =CH3OH (g)ΔH=-129.0 kJ·mol-1
CH4(g)+H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________.
-
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)  CH3OH(g) △H1②CO2(g)+3H2(g)
CH3OH(g) △H1②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)
CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)  CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=___________kJ•mol-1;已知△H2= -58 kJ•mol-1,则△H3= ____________kJ•mol-1。
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为___________.正极的电极反应式为________________.
(3)下图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
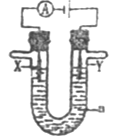
①若X为铁,Y为银,a为一定浓度的硝酸银溶液,通电后,Y极板上发生的电极反应式为:_____。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气_______L(假设空气中氧气体积分数为20%)。
-
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | 
| H—O | C—H |
| E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。
CH3OH(g) △H1〈0
CH3OH(g)+H2O(g) △H2
CO(g)+H2O(g) △H3〉0

H2(g)+I2(g)








