-
甲醇既是重要的化工原料,又可作为燃料,还可以作为燃料电池的原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
CH3OH(g) ΔH1 (已知:CO的结构与N2相似)
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=_____kJ·mol-1。
(2)已知:
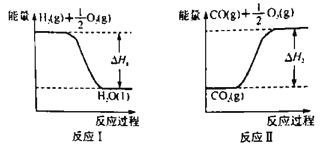
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)  CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
CH3OH(l)的ΔH=________。若ΔH1=-285.8 kJ·mol-1,ΔH2=+283.0 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______。
(3)以CH4和H2O为原料,通过下列反应也可以制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)= =CH3OH (g)ΔH=-129.0 kJ·mol-1
CH4(g)+H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________.
-
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)  CH3OH(g) △H1②CO2(g)+3H2(g)
CH3OH(g) △H1②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)
CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)  CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=___________kJ•mol-1;已知△H2= -58 kJ•mol-1,则△H3= ____________kJ•mol-1。
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为___________.正极的电极反应式为________________.
(3)下图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
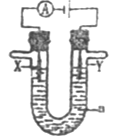
①若X为铁,Y为银,a为一定浓度的硝酸银溶液,通电后,Y极板上发生的电极反应式为:_____。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气_______L(假设空气中氧气体积分数为20%)。
-
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | 
| H—O | C—H |
| E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。
-
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/( kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJ•mol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
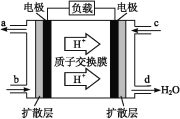
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
-
甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ• ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
-
甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ• ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
-
甲醇既是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=—58 kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 。下图中能正确反映该反应平衡常数K随温度变化关系的曲线为 (填“a”或“b”),其判断理由是 。
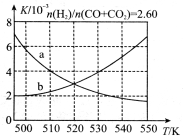
(2)合成气的组成 时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
(3)若在一定条件下,容积恒定为VL的反应室中充入amolCO与2amolH2,在催化剂作用下仅发生反应①,下列措施一定使c(CH3OH)/c(CO)增大的是 (填字母)。
A.升高温度 B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2 D.恒温恒容再充入a mol CO和2a mol H2
-
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 
| H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
-
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C←=O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是___________________________________________________。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________________________________。图2中的压强由大到小为__________,其判断理由是___________________________________。
-
甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C  O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
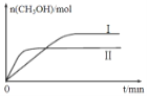
①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____________。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率________;该温度下的平衡常数为______;若保持容器温度不变,下列措施可增加甲醇产率的________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
CH3OH(g) △H1②CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g)
CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:





