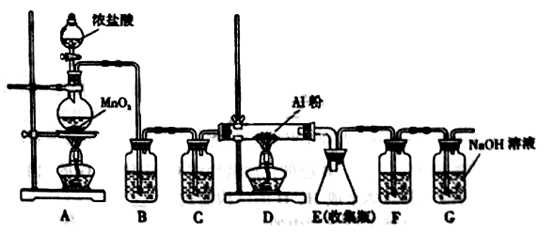
-
下列有关物质的性质和应用均正确的是( )
A.晶体硅具有半导体性质,可用于生产光导纤维
B.碳酸钠能够和酸反应,常用于治疗胃酸过多
C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D.硫酸铵的浓溶液能使蛋白质盐析,可用多次盐析的方法分离、提纯蛋白质
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,18gH218O含有的原子总数为3NA
B.标准状况下,4.2gCH2=CH2和CH3CH=CH2的混合气体中所含有的碳原子数为0.3NA
C.将0.1molCl2通入1L水中,转移的电子数目为0.1NA
D.0.1mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA
难度: 中等查看答案及解析
-
下列化学实验事实及其结论都正确的是( )
选项 实验事实 结论
A 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强
B 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝
C SiO2可以和NaOH溶液及HF溶液反应 SiO2属于两性氧化物
D 将SO2通入溴水中,溴水褪色 SO2具有漂白性
难度: 中等查看答案及解析
-
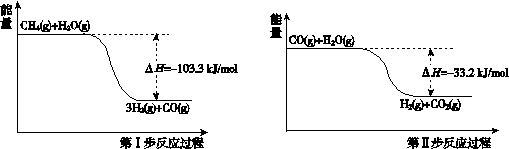
某化学反应的能量变化如图所示。下列有关叙述正确的是( )
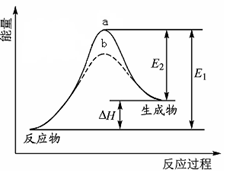
A.该反应的反应热△H=E2-E1
B.a、b分别对应有催化剂和无催化剂的能量变化
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
难度: 简单查看答案及解析
-
下列实验现象及相关的离子方程式均正确的是( )
A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体
CaCO3 + 2H+=Ca2+ + CO2↑ + H2O
B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+
C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色
2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀
Ba2+ + SO42- + H+ + OH-= BaSO4↓ + H2O
难度: 困难查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
难度: 中等查看答案及解析
-
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如右图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是( )
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
难度: 中等查看答案及解析
-
下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是( )
A.K+、Na+、NO3-、SiO32- B.Al3+、K+、SO42-、S2-
C.Ag+、Na+、NH3·H2O、NO3- D.Cu2+、Fe2+、Cl-、SO42-
难度: 困难查看答案及解析
-
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
装置
A(试管+粉末)
B
C
反应前
42.0g
75.0g
140.0g
反应后
37.0g
79.5g
140.0g

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.3CuSO4
3CuO + SO3↑ + 2SO2↑ + O2↑
B.4CuSO4
4CuO + 2SO3↑ + 2SO2↑ + O2↑
C.5CuSO4
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
D.6CuSO4
6CuO + 4SO3↑ + 2SO2↑ + O2↑
难度: 中等查看答案及解析
-
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是( )
难度: 中等查看答案及解析
-
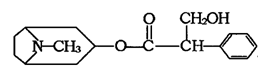
普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是

A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质在溶液中最多可与2molNaOH反应
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是


甲 乙 丙 丁
A.图甲可以判断出反应 A(g) + B(g)
2C(g) 的△H<0,T2>T1
B.图乙表示压强对可逆反应2A(g) + 2B(g)
3C(g) + D(s)的影响,乙的压强比甲的压强大
C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化
难度: 困难查看答案及解析
-
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:

下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)
Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
难度: 困难查看答案及解析
-
某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
难度: 困难查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)= 0. 1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是

A.X点所表示的溶液中:c(Na+)+ c(OH-) = c(CH3COO-) + c(H+)
B.W 点所表示的溶液中:c(Na+) +c(H+) -c(OH-) +c(CH3COOH)= 0. 1mol·L-1
C.该温度下醋酸的电离平衡常数为10-4.75 mol·L-1
D.向X点所表示的溶液中加入等体积的0. 05mol·L-1NaOH溶液:c(H+)= c(CH3COOH)+c(OH-)
难度: 困难查看答案及解析