-
下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
难度: 简单查看答案及解析
-
下列数据不一定随着温度升高而增大的是
A. 盐类水解常数Kh B. 弱电解质的电离平衡常数K
C. 化学平衡常数K D. 水的离子积Kw
难度: 简单查看答案及解析
-
25℃时,纯水中存在的平衡:H2O
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 金属腐蚀就是金属失去电子被还原的过程
B. 铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe- 3e- = Fe3+,继而形成铁锈
C. 将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀
D. 合金的熔点高于它的任何一种金属成分
难度: 简单查看答案及解析
-
对水的电离平衡不产生影响的微粒是
A. H+ B. 26M3+ C.
D.
难度: 简单查看答案及解析
-
常温下,将浓度为0.1mol/L NaF溶液加水稀释的过程中,下列各量始终保持增大的是
A. c(OH-) B. c(Na+)
C.
D. c(HF) / c(F-)
难度: 中等查看答案及解析
-
相同温度下,四种物质的量浓度相等的溶液中,c(NH
)最小的是
A. NH3·H2O B. NH4Cl C. CH3COONH4 D. NH4Al(SO4)2
难度: 中等查看答案及解析
-
25℃,由水电离产生的[H+]= 10-13mol/L的溶液中,下列各组离子一定能大量共存的是
A. Na+、Cu2+、NO3-、CH3COO- B. K+、Na+、Cl-、SO42-
C. K+、CO32-、NO3-、[Al(OH)4]- D. Na+、Fe2+、NO3-、Cl-
难度: 简单查看答案及解析
-
对于反应COCl2(g)
CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2浓度 C. 升温 D. 加催化剂
难度: 中等查看答案及解析
-
下列溶液蒸干并灼烧,最后得到固体是溶质本身的是
A. CuSO4 B. NaHCO3 C. KMnO4 D. FeCl3
难度: 简单查看答案及解析
-
用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
难度: 简单查看答案及解析
-
N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g) CO2(g)+N2(g) △H,有关化学反应的物质变化过程(图1)及能量变化过程(图2)如下:
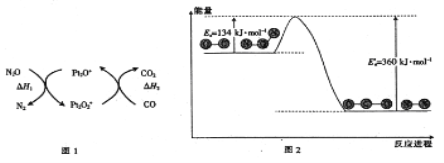
下列说法正确的是( )
A.由图1可知:△H1=△H+△H2
B.由图2可知△H =-226 kJ/mol
C.为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
D.由图2可知该反应正反应的活化能大于逆反应的活化能
难度: 中等查看答案及解析
-
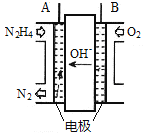
一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是

A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
难度: 简单查看答案及解析
-
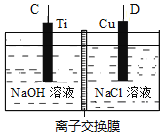
下列关于图示四个装置的叙述不正确的是
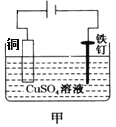
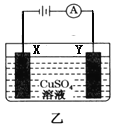
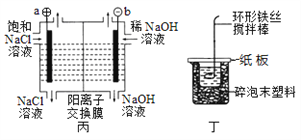
A. 装置甲是可以在铁钉上镀铜的装置
B. 装置乙若为电解精炼铜装置,则X电极为精铜
C. 装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D. 装置丁可用于测定化学反应的反应热
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 用广泛pH试纸测得某酸溶液的pH为2.3
B. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小体积可使体系颜色变深,此事实能用勒夏特列原理解释
C. 在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)
2NH3(g) △H =﹣38.6kJ/mol
D. 一定条件下2SO2(g)+O2(g)
2SO3(g) △H1 ,2SO2(g)+O2(g)
2SO3(l) △H2 则△H1>△H2
难度: 中等查看答案及解析
-
常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,记录数据如下表,下列说法中正确的是
混合后的溶液
加入的酸
酸的浓度/(mol·L-1)
混合后溶液的pH
①
HA
0.10
8.7
②
HB
0.12
2
A. HA是强酸,HB是弱酸
B. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+)
C. 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
D. 升高温度,溶液②中
增大
难度: 困难查看答案及解析
-
在密闭容器中,反应2NO2(g)
N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是

图a 图b
A. 图a 中,A1→A2变化的原因一定是充入了NO2
B. 图b中,E点对应状态中,v(正)> v(逆)
C. 图b中,E→A所需的时间为x,D→C所需时间为y,则x < y
D. 依据图b分析可知,该化学反应△H>0
难度: 中等查看答案及解析
-
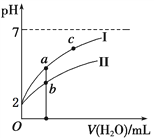
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是
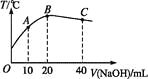
A. 醋酸的电离平衡常数:B点>A点
B. 由水电离出的c(OH-):B点>C点
C. 从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D. 从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析