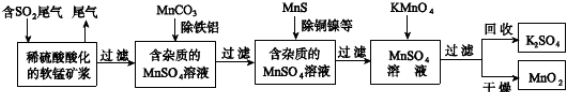
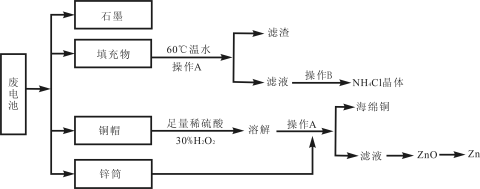
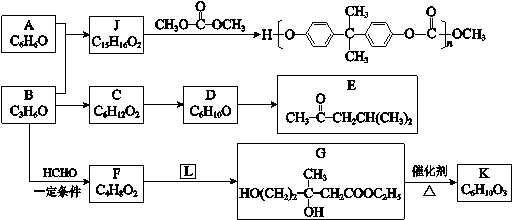
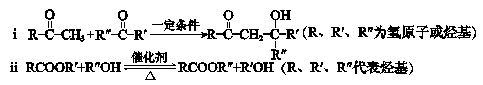-
化学与生产、生活息息相关,下列叙述错误的是( )
A.碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高
B.汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施
C.1kg人体脂肪可存储约32200kJ能量,一般人每行走1km大约要消耗170kg能量,如果每天步行5kg,一年(按365天计)中消耗的脂肪大约是9.6kg
D.炒菜用铁锅未及时洗净(残余中含NaCl),可能发生电化学腐蚀生成红褪色锈斑
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.NaClO溶液中通入少量SO2:ClO-+SO2+H2O=2H++SO42-+Cl-
B.FeCl3溶液中通入过量H2S气体:2Fe3++3H2S=2FeS↓+S↓+6H+
C.Na2CO3溶液中通入少量Cl2:2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3-
D.NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O=3H++SO42-+2Cl-
难度: 困难查看答案及解析
-
已知:Fe(OH)3不溶于过量氨水,Cu(OH)2溶于过量氨水,转化为[Cu(NH3)4]2+。现有等物质的量组成的铁铜合金0.1mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,硝酸的还原产物只有NO,由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是( )
A.根据溶液中的金属离子和残留固体的成分最多会有6种情况
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会再溶解
C.当合金刚好溶解时,在标准状况下产生2.24LNO
D.若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧,称量得固体5.35g
难度: 困难查看答案及解析
-
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)
N2O4(g) △H=-akJ/mol(a>0)。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
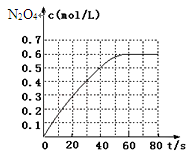
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.v(正)、v(逆)大小关系不确定
难度: 困难查看答案及解析
-
按如图所示装置连接,X、Y均为惰性电极,常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )
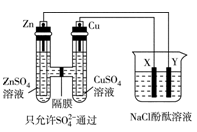
A.11 B.12 C.13 D.14
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.已知冰的熔化热为6.0 kJ﹒mol-1,冰中氢键键能为20 kJ﹒mol-1,假设1mol冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中30%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,K a=(ca)2/C(1−a).若加入少量CH3COONa固体,则电离平衡CH3COOH
CH3COO-+H+向左移动,a减小,Ka不变
C.检测得环已烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ.mol-1、-3747 kJ.mol-1和-3265kJ.mol-1可以证明在苯分子中不存在独立的碳碳双键
D.进行中和热反应中,如果不把温度计上的酸用水冲洗掉,那么根据cm△t计算得到的Q结果会偏小
难度: 中等查看答案及解析
-
下列有关实验室常用仪器和实验操作正确的是( )
A.实验室用浓硫酸和乙醇制乙烯时,应把温度计的水银球靠近蒸馏烧瓶的支管口处
B.用浓硫酸配置一定物质的量浓度的稀硫酸时,应在量取浓硫酸后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
C.液态溴应贮存在磨口的细口瓶中,加水液封,加盖橡胶塞,并放置于阴凉处
D.应用渗析法提纯胶体时,要不断更换烧杯中的水(或用流动的水)以提高渗析效果
难度: 中等查看答案及解析