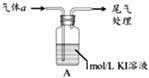
-
二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中 =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
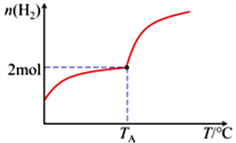
①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq) NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1) H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq) HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
| Kb(NH3·H2O) | 2×10-5 |
| Ka1(H2CO3) | 4×10-7 |
| Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
-
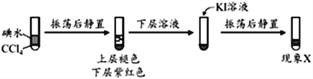
铬铁矿的成分主要为FeCr2O4,另含有少量Al2O3和SiO2。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:

已知“混熔盐”中含有Na2CrO4和NaFeO2等成分,其中NaFeO2极易水解。试回答下列问题:
(1)“滤渣1”为红褐色沉淀,其化学式为_________________;通过水浸生成红褐色沉淀的化学方程式为_________________________________。
(2)向滤液①中加H2SO4“调“pH”的目的:一是使CrO42-转化为Cr2O72-,离子方程式为___________________________________;二是____________________________。
(3)“煅烧”铬铁矿时,主要成分反应的化学方程式为____________________________。
(4)根据下图溶解度(S)~温度(T)曲线判断,对滤液②进行的最佳“分离”方法为_____________(填序号)。
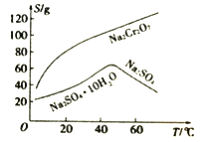
A.蒸发结晶 B.蒸发浓缩,趁热过滤 C.蒸发浓缩,冷却结晶,过滤
(5)“反应”的离子方程式为____________________________。
(6)Cr(OH)3溶于盐酸生成配离子[CrCln(H2O)6-n]x+。0.0015mol[CrCln(H2O)6-n]x+与氢离子交换树脂(HR)完全发生离子交换:[CrCln(H2O)6-n]x++xHR→Rx[CrCln(H2O)6-n] +xH+,生成的H+可与25.00mL 0.1200mol/L NaOH溶液恰好中和。则该配离子的化学式为__________________。
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少___________?(列式计算)
-
半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)在现代化学中,常利用______________(填“原子光谱”或“分子光谱”) 上的特征谱线来鉴定元素,称为光谱分析。
(2)基态P原子的价电子排布式为_______,同周期中第一电离能比P小的元素有_______种。
(3)在水中的溶解度BBr3_________PBr3(填“>”或“<”),原因是____________________。
(4)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,阴阳离子均带一个电位电荷,经测定其中P-Br键键长均相等。写出该导电熔体中阳离子的电子式:_____________,其中P原子的杂化轨道类型是_____________________。
(5)已知磷化硼晶体中P原子作面心立方最密堆积,若某个P的原子坐标为(0,0,0),则晶胞中其余P原子的坐标为______________ (写出一个即可),B原子填入四面体空隙中,B的原子坐标分别为( ,
, ,
, )、(
)、( ,
, ,
, )、(
)、( ,
, ,
, )、(
)、( ,
, ,
, ),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
-
现有以异丁烯为原料合成某二酸的合成路线如下:

已知:R-CH2CN R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是_______________,B的官能团名称是_______________________。
(2)步骤③的反应类型是____________________________。
(3) 同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:______________________________。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式______________________。
(5)写出步骤⑥的化学方程式___________________________________。
(6)均符合下列条件B的同分异构体有________个。
a.所有碳原子一定共平面; b.核磁共振氢谱有3 组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成 的路线流程______。
的路线流程______。


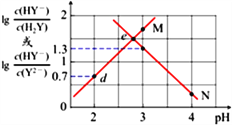
与pH的变化关系





 R-CH2COONa+NH3
R-CH2COONa+NH3