-
化学在人类生活中扮演着重要角色,以下应用正确的是
A.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
B.日常生活中无水乙醇常用于杀菌消毒
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
难度: 中等查看答案及解析
-
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2S
A.③④ B.②③④ C.①③④ D.全部
难度: 中等查看答案及解析
-
假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6 D.KAlSi3O8 D.KAlSi4O10
难度: 中等查看答案及解析
-
某可逆反应aA + bB
cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
A.写成2aA + 2bB
2cC,Q值、K值均扩大了一倍
B.写成2aA + 2bB
2cC,Q值扩大了一倍,K值保持不变
C.写成cC
aA + bB,Q值、K值变为原来的相反数
D.写成cC
aA + bB,Q值变为原来的相反数,K值变为倒数
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.500 mL 2 mol·L-1 FeCl3溶液中Fe3+数为NA,且
=3
B.1 L pH=1的硫酸溶液中含有的H+为0.2NA
C.标准状况下,22.4L 乙烷中含极性共价键的数目为7NA
D.12 g石墨和C60的混合物中质子总数一定为6NA个
难度: 中等查看答案及解析
-
限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:
2H++
= H2O+SO2↑的化学反应个数有
A.4 B.5 C.8 D.12
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示。

仅用此装置和表中提供的物质完成相关实验,最合理的是
选项
a中物质
b中物质
c中收集的气体
d中物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
饱和食盐水
电石
CH≡CH
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,它们的简单离子中都能破坏水的电离的组合是
A.Y3+、W- B.Z2-、X+ C.X+、Y3+ D.X+、Z2-
难度: 中等查看答案及解析
-
有三种不同的集团,分别为-X、-Y、-Z,若同时分别取代苯环上的三个氢原子,能生成的同分异构体数目是
A.4种 B.6种 C.8种 D.10种
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:
2A(g)+B(g)
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为20 L,C的平衡浓度变为原来的一半
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
难度: 中等查看答案及解析
-
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 = HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- = CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 = 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-= BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
难度: 困难查看答案及解析
-
药物贝诺酯的结构简式如图所示,下列有关叙述正确的是
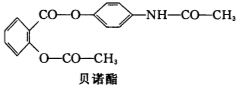
A.贝诺酯分子式为C17H15NO5
B.1mol贝诺酯分子最多能与9mol H2反应
C.贝诺酯与足量NaOH溶液共热,最终生成两种产物
D.贝诺酯能发生的反应类型有取代反应、氧 化反应、 消去反应等
难度: 中等查看答案及解析
-
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。

则下列有关说法错误的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
难度: 中等查看答案及解析
-
[化学——选修三:物质结构与性质](15分)
2011年3月11日日本发生了9.0级强地震。福岛第一核电站1号机组12日下午发生氢气爆炸。随后在爆炸核电站周围检测到的放射性物质有碘-131和铯—137,碘-131一旦被人体吸入,可能会引发甲状腺疾病。日本政府计划向核电站附近居民发放防止碘-131辐射的药物碘片。
(1)Cs(铯)的最外层电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素A、B、C的电离能如下表:
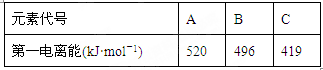
那么三种元素C的元素符号为____________,形成其单质晶体的化学键类型__________。
(2)F、Cl、Br与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别是________、________。与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物,非金属氯化物等。BCl3是一种非金属氯化物,该物质分子中B—Cl键的键角为________。基态溴原子的简化电子排布式为 _____ 。
(3)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为_______ __。
(4)测定气态氟化氢分子量总大于20,你认为可能的原因为 。
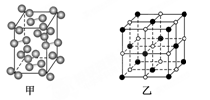
(5)碘—131是碘单质,其晶胞结构如下图甲所示,该晶胞中含有________个I2分子;KI的晶胞结构如下图乙所示,每个K+紧邻________个I-。
难度: 困难查看答案及解析