-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.用核磁共振氢谱可以鉴别1一溴丙烷和2一溴丙烷
B.对于可逆反应N2(g)+3H2(g)2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同难度: 中等查看答案及解析
-
下列实验操作正确且能达到预期目的是( )
实验目的 操 作 1 比较水和乙醇中羟基氢的活泼性强弱 用金属钠分别与水和乙醇反应 2 欲证明CH2=CHCHO中含有碳碳双键 滴入KMnO4酸性溶液,看紫红色是否褪去 3 欲除去苯中混有的苯酚 向混合液中加入浓溴水,充分反应后,过滤 4 证明SO2具有漂白性 将SO2通入酸性KMnO4溶液中 5 比较确定铜和镁的金属活动性强弱 用石墨作电极电解Mg(NO3)2、Cu( NO3)2 的混合液 6 确定碳和硅两元素非金属性强弱 测同温同浓度Na2CO3和Na2SiO3水溶液的pH
A.①⑤⑥
B.①②⑥
C.①③④
D.②④⑥难度: 中等查看答案及解析
-
可逆反应mA(s)+nB(g)⇌pC(g)+qD(g)反应过程中,当其他条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )
A.达到平衡后,若使用催化剂,C的体积分数将增大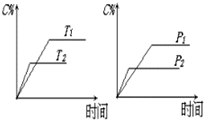
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>p+q
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸难度: 中等查看答案及解析
-
下列各溶液中,有关成分的物质的量浓度关系正确的是( )
A.10mL0.5mol/LCH3COONa溶液与6mLlmol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.lmol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe(SO4)2溶液和NH4C1溶液:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl)难度: 中等查看答案及解析
-
下列三种有机物是某些药物中的有效成分.
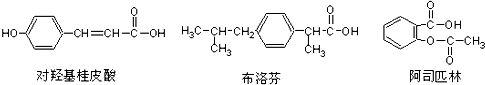
下列说法正确的是( )
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物难度: 中等查看答案及解析