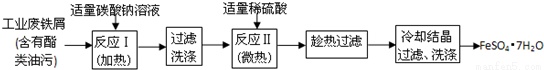
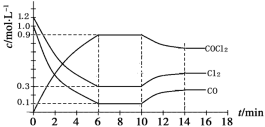
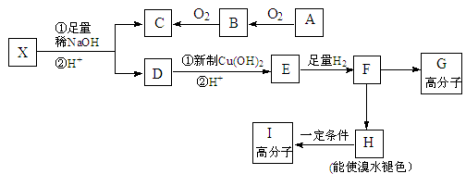
-
下列有关说法正确的是( )
A.煤的气化、液化、干馏以及石油的分馏、裂化、裂解均属化学变化
B.明矾、水玻璃、纯碱、干冰分别属于纯净物、混合物、电解质、非电解质
C.活性炭、12C、石墨烯、金刚石互为同素异形体
D.光化学烟雾、温室效应、硝酸型酸雨的形成都与氮氧化物有关
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.铁红溶于足量HI溶液中:Fe2O3 + 6H+ = 2Fe3+ + 3H2O
B.锅炉中可以用纯碱除水垢: CaSO4 + CO32-═ CaCO3+ SO42-
C.小苏打治疗胃酸过多:CO32- + 2H+ = CO2↑ + H2O
D.FeBr2溶液中通入少量Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl-
难度: 中等查看答案及解析
-
下列除杂方案合理的是( )
A.除去苯中的少量苯酚:加浓溴水,过滤
B.除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液
C.除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸
D.除去MgCl2溶液中少量的FeCl3:加入稍过量氢氧化钠,过滤
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在标准状况下,44.8L SO3所含有的分子数为2NA
B.含4mol HNO3的浓硝酸与足量铜反应,生成NO2分子数为2NA
C.常温常压下,44g由N2O和CO2组成的混合气体所含的分子数为NA
D.粗铜精炼时转移1mol电子,阳极上溶解的Cu原子数一定为0.5 NA
难度: 中等查看答案及解析
-
A、B、C、D是原子序数依次增大的短周期元素,其原子的最外层电子数之和为19,A原子质子数是B原子质子数的一半,B2+ 和D-离子的电子数之差为8。下列说法不正确的是( )
A.A与C形成离子化合物 B.原子半径:B>C>D>A
C.AD4分子空间构型为正四面体 D.A、B之间能发生置换反应
难度: 中等查看答案及解析
-
某温度下反应2A(g)
B(g) + C(g) ΔH<0的平衡常数K=400。此温度下,在1 L的密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol·L-1)分别为:0.44、0.6、0.6,下列说法正确的是( )
A.温度升高,该反应反应速率加快,平衡常数增大
B.此时正、逆反应速率的大小为v正>v逆
C.经10 min反应达到平衡,则该时间内反应速率v(A)为0.04mol/(L·min)
D.平衡时,再加入与起始等量的A,达新平衡后A转化率增大
难度: 中等查看答案及解析
-
常温下,下列有关叙述错误的是( )
A.向冰醋酸中逐滴加水稀释的过程中,溶液
先减小后增大
B.等体积等浓度的CH3COONa、NaClO溶液中,前者离子总数大于后者
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH)
难度: 中等查看答案及解析