-
已知A、B、C、D、E是原子序数依次增大的五种元素,A元素核内只有质子;B元素的某种核素可用于考古;D原子核外电子排布为nsnnpn+2。E是第四周期元素,最外层只有一个电子,其余各层电子均充满。请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的基态原子的电负性由大到小的顺序为 (用元素符号表示)。
化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(2)A、B、D三种元素组成的一种化合物是新装修居室中常含有的一种有害气体。则分子中B原子轨道的杂化类型为 。
(3)E的核外电子排布式为 。E2D为半导体材料,在其立方晶胞内部有4个D原子,其余D原子位于面心和顶点,则该晶胞中有______个E原子。E2D能与稀硫酸反应得E,E的晶胞为面心立方最密堆积,已知该晶体的密度为9.00g/cm3,则E原子的半径为 cm。
(4)C2A4与ED在碱性溶液中反应生成无色气体和红色沉淀,则该反应的化学方程式可表示为: 。
高三化学填空题中等难度题查看答案及解析
-
X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H= - 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H = -1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
高三化学填空题中等难度题查看答案及解析
-
X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是______;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因_____。
(2)Z原子的第一电离能比氧原子的____(填“大”或“小”);G的基态原子电子排布式是__________
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是_________;该化合物中Y的杂化轨道类型是________。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是____________
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=-574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H = -1160kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式________。
高三化学综合题中等难度题查看答案及解析
-
A、B、C、D、E 是原子序数依次增大的五种常
见元素,其中 A 是原子半径最小的元素,B 元素的一种核素可用于考古断代,D 元素的 s轨道和 p 轨道上的电子数相等且有2个未成对电子;E 是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D 四种元素中,电负性最大的是________,第一电离能最大的是________。
(2)化合物 CA3 的沸点比化合物 BA4 的高,其主要原因是___________________________ 。
(3)A、B 形成的化合物与氢氰酸(HCN)反应可得丙烯腈(H2CCHCN),丙烯腈分子中的碳原子轨道杂化类型是__________。
(4)由 C 元素形成的一种离子与 BD2 互为等电子体,该离子的结构式为__________。
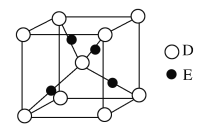
(5)基态 E 原子的核外电子排布式为:_____________________________;D、E 形成的某种化合物的晶胞结构示意图如下,该晶体的化学式为__________。

(6)向 E 的硫酸盐溶液中通入过量的 CA3,可生成[E(CA3)4]2+,1 mol [E(CA3)4]2+中含有σ 键的数目约为____________。
高三化学综合题中等难度题查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种常见元素,其中A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等且有2个未成对电子;E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是___,第一电离能最大的是___。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是____。
(3)A、B形成的化合物M与氢氰酸(HCN)反应可得丙烯腈(H2C=CH—C≡N),则M的结构式为___,丙烯腈分子中碳原子轨道杂化类型是____。
(4)由C元素形成的一种离子与BD2互为等电子体,该离子的结构式为____。
(5)基态E原子的核外电子排布式为____,如图是D、E形成的某种化合物的晶胞结构示意图,该晶体的化学式为____。
(6)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+,1mol[E(CA3)4]2+中含有σ键的数目约为___。
高三化学综合题中等难度题查看答案及解析
-
现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大。A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等。C、E是同主族元素,它们的核外均有3个未成对电子。请回答下列问题:
(1)基态E原子有_____种能量不同的电子。
(2)六种元素中,电负性最大的是_______,第一电离能最大的是________(均填元素符号)。
(3)化合物CA3的沸点比化合物BA4的沸点高,其主要原因是____________。
(4)CD2-的立体构型是________,其中C原子的杂化类型为___________。
(5)C2A4溶于水电离方程式与CA3溶于水电离方程式相似,试写出C2A4在水溶液中的电离方程式____(写一步即可,要求用化学符号表示)。
(6)开发金属储氢材料是氢能的重要研究方向。MgA2是一种储氢材料,其晶胞结构如下图所示:
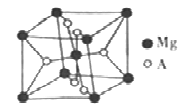
已知该晶胞的体积为Vcm3,则该晶胞的密度为_______g·cm-3(用V和NA表示)。
高三化学推断题困难题查看答案及解析
-
现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大。A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等。C、E是同主族元素,它们的核外均有3个未成对电子。请回答下列问题:
(1)基态E原子有_____种能量不同的电子。
(2)六种元素中,电负性最大的是_______,第一电离能最大的是________(均填元素符号)。
(3)化合物CA3的沸点比化合物BA4的沸点高,其主要原因是____________。
(4)CD2-的立体构型是________,其中C原子的杂化类型为___________。
(5)C2A4溶于水电离方程式与CA3溶于水电离方程式相似,试写出C2A4在水溶液中的电离方程式____(写一步即可,要求用化学符号表示)。
(6)开发金属储氢材料是氢能的重要研究方向。MgA2是一种储氢材料,其晶胞结构如下图所示:
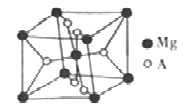
已知该晶胞的体积为Vcm3,则该晶胞的密度为_______g·cm-3(用V和NA表示)。
高三化学推断题困难题查看答案及解析
-
X、Y、Z、W、P是短周期主族元素,它们的原子序数依次增大,其中X的族序数=周期序数=原子序数,Y的最外层电子数等于其次外层电子数的2倍,它的一种核素常用于考古断代,W的一种单质被喻为“人类地球的保护伞”,P的最高正化合价与最低负化合价的代数和为4,下列说法正确的是( )
A.由X、Z、P三种元素形成的化合物只能是共价化合物
B.Y、Z、W、P氢化物的稳定性依次增强
C.食品中可适量添加PW2,起到去色、杀菌、抗氧化的作用
D.Y5X10W2能与碳酸氢钠反应的结构有三种
高三化学单选题中等难度题查看答案及解析
-
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表。下列说法正确的是
元素
信息
X
K层电子数是L层电子数的2倍
Y
一种核素在考古时常用来鉴定一些文物的年代
Z
所处的周期序数与族序数相等
W
最高价氧化物对应的水化物酸性最强
A.W的阴离子半径大于Z的阳离子半径
B.Y的氢化物比W的氢化物稳定
C.Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物
D.X在氧气中加热反应生成X2O2
高三化学选择题中等难度题查看答案及解析
-
X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的1/2,下列说法正确的是
A. 简单离子半径M>W>Z>X
B. M2W2与足量的CO2完全反应,转移2mol电子时增重28g
C. X、Z两种元素只能组成化学式为ZX3的化合物
D. 由X、Y、Z、W四种元素形成的化合物既有共价化合物也有离子化合物
高三化学单选题中等难度题查看答案及解析