-
一些化学试剂瓶上贴有危险警告标志,下列物质的试剂瓶上所贴化学品标志有错误的是
A B C D
物质 Na2CO3 液氨 浓H2SO4 K2Cr2O7
危险警告标识


难度: 简单查看答案及解析
-
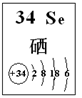
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于8939Y的说法不正确的是
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数是39 D.8939Y和9039Y是两种不同的核素
难度: 中等查看答案及解析
-
下列有关胶体的说法不正确的是
A.利用丁达尔效应可以区分胶体和溶液
B.胶体中分散质粒子的直径在1~100 nm之间
C.向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体
D.将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸孔隙
难度: 中等查看答案及解析
-
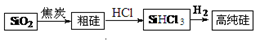
下列说法不正确的是
A.水玻璃可用作木材防火剂 B.硅是制造光导纤维的材料
C.硅是制造太阳能电池的常用材料 D.硅是构成一些岩石和矿物的基本元素
难度: 中等查看答案及解析
-
下列有关金属的说法中不正确的是
A.纯铁比生铁抗腐蚀性强
B.青铜、不锈钢、硬铝都是合金
C.铝在空气中耐腐蚀,所以铝是不活泼金属
D.人体缺钙会引起骨质疏松症,缺铁会引起贫血
难度: 简单查看答案及解析
-
下列关于钠的化合物的说法正确的组合是
①NaCl可作厨房调味品,也可用于氯碱工业
②Na2O2可用于呼吸面具或潜水艇中的供氧剂
③Na2CO3水溶液显碱性,可用于去除油污
④NaHCO3受热易分解放出CO2,可用来制作糕点
A.只有①②③ B.只有①③④ C.只有②③④ D.①②③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO、CO2组成元素相同,都能将Fe2O3还原成Fe
B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐
C.Na2O、Na2O2为相同元素组成的金属氧化物,与 CO2反应产物相同
D.浓硫酸、浓硝酸、稀硝酸均具有强氧化性,常温下均可用铝制容器盛放
难度: 中等查看答案及解析
-
下列溶液中的各组离子,通入过量SO2气体后仍能大量存在的是
A.Ba2+、Ca2+、Cl- B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl- D. H+、Fe3+、NO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数。下列叙述不正确的是
A.标准状况下,22.4 L O3含有分子的数目为NA
B.常温常压下,4.0 g CH4中含有共价键的数目为NA
C.常温常压下,1 L 0.1 mol·L-1 NH4NO3溶液中NH4+、NO3-的数目均为0.1NA
D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA
难度: 中等查看答案及解析
-
下列关于铝及其化合物的说法不正确的是
A.Al 既可用于食品包装,也可用做建筑材料
B.Al2O3既可用来冶炼金属Al,也可用做耐火材料
C.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂
D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
难度: 中等查看答案及解析
-
下列方程式不正确的是
A.用稀H2SO4吸收氨气:NH3+H+=NH4+
B.用CaO吸收汽车尾气中的NOx:CaO+ NO+NO2==Ca(NO2)2
C.向海带灰的浸出液中(酸性)加入双氧水提取I2:2I-+H2O2+2H+==I2+2H2O
D.足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
分别取四种溶液于四支试管中进行实验,结论正确的是
操作 现象 结论
A 加入浓NaOH溶液,加热 湿润的红色石蕊试纸变蓝 原溶液中一定含有NH4+
B 加入稀盐酸,将产生的气体通入澄清石灰水中 溶液变浑浊 原溶液中一定含有CO32-
C 加入少量双氧水,再加几滴KSCN溶液 溶液变红 原溶液中一定含有Fe2+
D 加入BaCl2溶液,再加入稀硝酸 有白色沉淀生成 原溶液中一定含有SO42-
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将FeCl3溶液加热蒸干得到FeCl3固体
B.向Fe(NO3)2溶液中加少量盐酸,无明显现象
C.向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象
D.向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色
难度: 中等查看答案及解析
-
下列叙述正确的是
A.电解氯化镁溶液可获得金属镁
B.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管
C.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
D.向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染
难度: 中等查看答案及解析
-
下列各项中,理由、结论及因果关系均正确的是
选项 理由 结论
A 相同物质的量浓度溶液的pH:BaCl2>MgCl2 碱性:Ba(OH)2>Mg(OH)2
B 相同物质的量的原子失去电子的数目:Al>Na 还原性:Al>Na
C 相同数目的分子中可电离的H+数:H2SO4>HClO 酸性:H2SO4>HClO
D 相同物质的量得到电子的数目:稀硝酸>浓硝酸 氧化性:稀硝酸>浓硝酸
难度: 中等查看答案及解析
-
已知:C(s,石墨) == C(s,金刚石) ΔH = +1.9 kJ·mol-1。下列有关说法正确的是
A.相同条件下,1 mol石墨比1 mol金刚石能量高
B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
C.若:C(s,石墨) + O2(g)== CO2(g) ΔH1=-393.5 kJ•mol-1
则有:C(s,金刚石) + O2(g)== CO2(g) ΔH2=-395.4 kJ·mol-1
D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为ΔH<0
难度: 中等查看答案及解析
-
将X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体
Y溶液
预测的现象
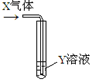
①
CO2
饱和Na2CO3溶液
白色沉淀析出
②
SO2
Ba(NO3)2溶液
白色沉淀析出
③
Cl2
AgNO3溶液
白色沉淀析出
④
NH3
AlCl3溶液
白色沉淀析出
A.只有①②③ B.只有①②④ C.只有①③④ D.①②③④
难度: 中等查看答案及解析
-
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
A.该未知物X为Na2SO4
B.该反应的氧化剂是KIO3
C.该反应中,发生氧化反应的过程是KIO3→I2
D.由反应可知还原性强弱顺序为:Na2SO3>I2
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
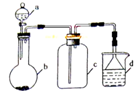
选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓硝酸 Cu NO2 NaOH溶液
B 浓氨水 CaO NH3 H2O
C 稀硝酸 Cu NO H2O
D 浓硫酸 Cu SO2 饱和NaHSO3溶液
难度: 中等查看答案及解析
-
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X
Y
Z
M
R
Q
原子半径/nm
0.186
0.074
0.099
0.143
主要化合价
-4,+4
-2
-1,+7
+3
其它
阳离子核
外无电子
无机非金属材料的主角
焰色反应呈黄色
下列说法正确的是
A.X与M形成的化合物中含有离子键
B.Z、M、Q三种元素的简单离子的半径:M>Z>Q
C.Y与R形成的化合物中R呈正价,说明Y的非金属性比R强
D.在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)
4NO2 (g)+ O2(g) ΔH > 0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
100 0
150 0
c(N2O5)/ mol·L-1
5.00
3.52
2.50
2.50
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
难度: 中等查看答案及解析