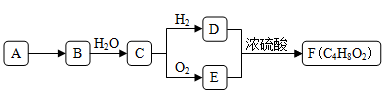
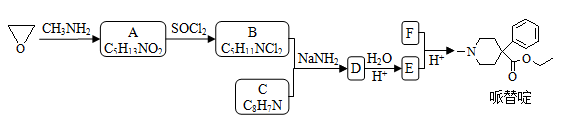
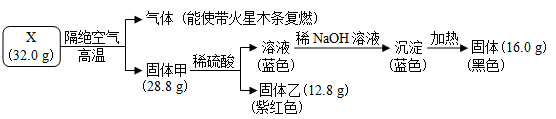
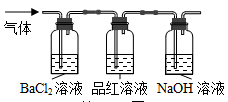
-
下列属于盐的是
A. NaCl B. KOH C. HNO3 D. CO3
难度: 简单查看答案及解析
-
仪器名称为“量筒”的是
A.
B.
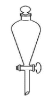 C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列属于非电解质的是
A. 葡萄糖 B. 氢氧化钠 C. 氯化钾 D. 铁
难度: 简单查看答案及解析
-
下列属于氧化还原反应的是
A. 2NaHCO3
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
难度: 简单查看答案及解析
-
下列分散系能产生“丁达尔效应”的是
A. 稀硫酸 B. 硫酸铜溶液 C. 氢氧化铁胶体 D. 酒精溶液
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 二氧化碳是酸雨的主要成分 B. 氢气是一种理想的清洁燃料
C. 碳酸氢钠可用于治疗胃酸过多 D. 氯化铁溶液可用于制作印刷铜电路板
难度: 简单查看答案及解析
-
下列表示不正确的是
A. CO2的电子式
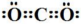 B. Cl2的结构式Cl—Cl
B. Cl2的结构式Cl—ClC. CH4的球棍模型
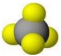 D. Cl-的结构示意图
D. Cl-的结构示意图
难度: 简单查看答案及解析
-
下列能使湿润的红色石蕊试剂变蓝的气体是
A. NH3 B. SO3 C. HCl D. CO3
难度: 简单查看答案及解析
-
下列物质放入水中,会显著放热的是
A. 食盐 B. 蔗糖 C. 酒精 D. 生石灰
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 实验室应将钠保存在煤油中 B. 分液漏斗和容量瓶在使用前都要检漏
C. 可用酒精代替CCl4萃取碘水中的碘单质 D. 金属镁失火不可用水来灭火
难度: 简单查看答案及解析
-
下列说法正确的是
A. 金刚石和石墨互为同素异构体,熔点和硬度都很高
B. 氕、氘、氚是氢元素的三种核素,质子数都为1
C. 乙醇和二甲醚(CH3—O—CH3)互为同系物
D. C4H10的一氯取代物只有一种
难度: 中等查看答案及解析
-
已知:X(g)+2Y(g)
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A. 澄清石灰水中通入过量的二氧化碳CO2+OH-=HCO3-
B. 金属钠和水反应2Na+2H2O=2Na++2OH-+H2↑
C. 酸性氧化亚铁溶液中加入双氧水2Fe2++H4O3=2Fe3++O2↑+2H+
D. 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O=BaSO4↓+2H+
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示。下列说法不正确的是
A. Z、Y、X的原子半径依次减小,非金属性依次降低
B. Z、Y、W的最高价氧化物的水化物的酸性依次降低
C. WH4与Z元素的单质在一定条件下可发生化学反应
D. W的位置是第2周期,第IV A族
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 1mol乙烷在光照条件下最多能与3molCl2发生取代反应
B. 石油裂解气能使溴的四氯化碳溶液,酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯可通过取得反应制得硝基苯、氯苯
难度: 中等查看答案及解析
-
下列说法正确的是
A. 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚
B. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出甘油
C. 氨基酸为高分子化合物,种类较多,分子中都含有—COOH和—NH3
D. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
难度: 中等查看答案及解析
-
银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
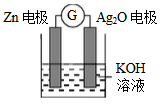
A. Zn电极是负极
B. Ag2O电极发生还原反应
C. Zn电极的电极反应式:Zn-2e-++2OH-=Zn(OH)2
D. 放电前后电解质溶液的pH保持不变
难度: 中等查看答案及解析
-
室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
难度: 困难查看答案及解析
-
已知断裂1mol H2(g)中的H—H键需要吸收436.4kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出462.8kJ的能量。下列说法正确的是
A. 断裂1mol H2O中的化学键需要吸收925.6kJ的能量
B. 2H2(g)+ O2(g)=2H2O (g) △H=-480.4 kJ·mol-1
C. 2H2O(l) = 2H2 (g) + O2(g) △H=-471.6 kJ·mol-1
D. H2(g)+ 1/2O2(g)=H2O (l) △H=-240.2 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A. 干冰和石英晶体中的化学键类型相同,熔化时需客服微粒间的作用力类型也相同
B. 化学变化发生时,需要断开应物中的化学键,并形成生成物中的化学键
C. CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D. NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响
难度: 中等查看答案及解析
-
对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间
水样
0
5
10
15
20
25
Ⅰ(pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ(pH=4,含Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
B. 水样酸性越强,M的分解速率越快
C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L乙醇中碳氢键的数目为0.5NA
B. 1L0.1 mol·L-1碳酸钠溶液中含有的氧原子数为0.4NA
C. 0.1 mol KI与0.1 mol FeCl2在溶液中反应转移的电子数为0.1NA
D. 0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA
难度: 中等查看答案及解析
-
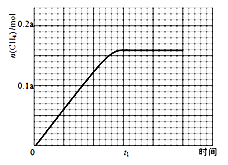
25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。
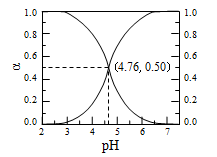
下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
难度: 困难查看答案及解析
-
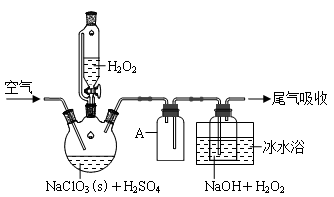
由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
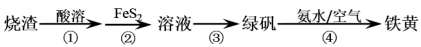
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
难度: 困难查看答案及解析
-
某固体混合物中可能含有:K+、Na+、Cl-、CO32-、SO42-等离子,将该固体溶解所得到的溶液进行了如下实验:
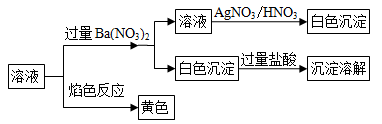
下列说法正确的是
A. 该混合物一定是K2CO3和NaCl B. 该混合物可能是Na2CO3和KCl
C. 该混合物可能是Na2SO4和Na2CO3 D. 该混合物一定是Na2CO3和NaCl
难度: 中等查看答案及解析