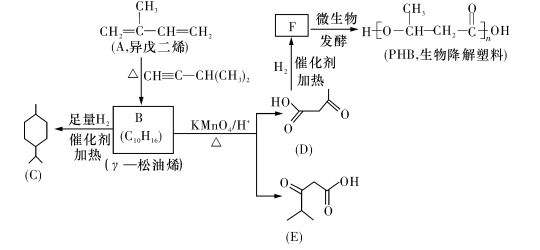
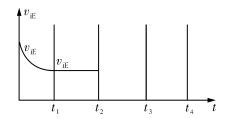
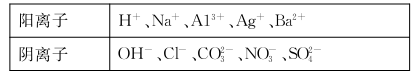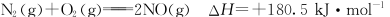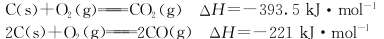-
下图为雾霾的主要成分示意图。下列说法不正确的是
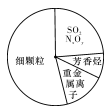
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.12g石墨和C60的混合物中质子总数为6NA
B.lLpH=l的硫酸溶液中含有的H+数为0.2NA
C.78gNa202固体中含有的阴离子数为2NA
D.500mL2mol.L-lFeCl2溶液中Fe3+数为NA,且
=3
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应A(g)
2B(g)△H,若正反应的活化能为EakJ.mol-l,逆反应的活化能为EbkJ.mol-l,则△H=-(Ea-Eb)kJ.mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol.L-1的CH3COOH溶液与0.1mol.L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)一2c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol.L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,
始终保持增大
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸
B.向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4)
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-
I2+I-
难度: 中等查看答案及解析
-
已知如下反应:O2+ PtF6 =O2( PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是
A.O2是氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1
C.O2(PtF6)中不存在共价键
D.每生成1molO2(PtF6)则转移1mol电子
难度: 中等查看答案及解析
-
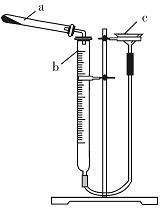
利用右图所示装置进行下列实验,能得出相应实验结论的是
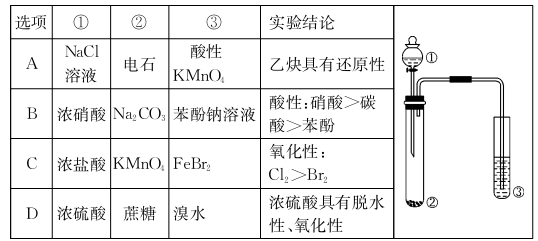
难度: 中等查看答案及解析
-
强酸性溶液X中可能含有
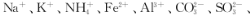
中的若干种,某同学为了确认其成分,取溶液X进行连续实验,实验过程及产物如下:
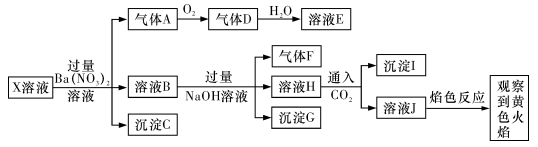
下列结论正确的是
A.X中肯定存在
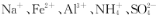
B.气体F经催化氧化可直接生成气体D
C.沉淀C-定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3。
D.X中不能确定的离子是Al3+、Na+、K+和Cl-
难度: 困难查看答案及解析
-
在电解冶炼铝的电解槽中存在电解质W2[X2Y2Z4]。已知其涉及的四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半。下列说法正确的是
A.原子序数:W>X>Y>Z
B.原子半径:W>X>Y>Z
C.W的最高价氢氧化物的碱性比X弱
D.Y的最简单氢化物的稳定性比Z的强
难度: 中等查看答案及解析
-
2015年10月5日,中国科学家屠呦呦首次获得诺贝尔医学和生理学奖,以表彰她发现了一种药物——青蒿素,它是一种治疗疟疾的特效药,其结构简式如图1所示。下列有关青蒿素的说法错误的是
A.青蒿素的摩尔质量为282g/mol
B.青蒿素分子内的O-O基团可能对疟原虫有抑制作用
C.青蒿素耐高温且易溶于水,不易溶于乙醚、乙酸乙酯等有机溶剂
D.药效比青蒿素高10倍的双氢青蒿素(图2)化学式为C15H2405
难度: 中等查看答案及解析
-
已知M(C8Hl602),发生水解反应可生成A、B两种化合物,在一定条件下A可转化为B,则所有A、B反应生成的物质有
A.2种 B.4种 C.6种 D.8种
难度: 困难查看答案及解析
-
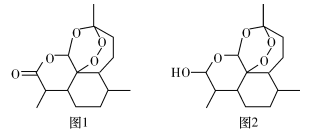
在加热固体NH4Al(SO4)2.l2H20时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4)3,下列判断正确的是
A.O℃一T℃的过程变化是物理变化
B.C点物质是工业上冶炼铝的原料
C.A—B反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,可用离子方程式表示为:Al3++30H-=A1(OH)3
难度: 极难查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H20- CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
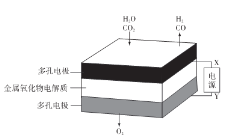
A.X是电源的负极
B.阴极的反应式是:H2O+2e-=H2+O2-,
C.总反应可表示为:H2O+CO2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1:2
难度: 中等查看答案及解析
-
根据下图,可判断出下列离子方程式中,错误的是
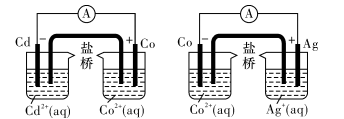
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
难度: 中等查看答案及解析
-
已知反应:2NO2(红棕色)
N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
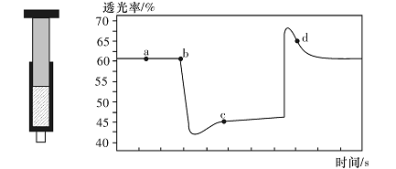
A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
难度: 困难查看答案及解析
-
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如下表
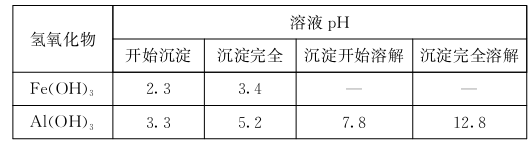
向FeCl3、Al2( S04)3的混和溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。以下推断错误的是
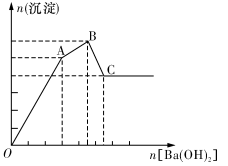
A.AB段可能发生的反应是:
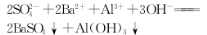
B.C点对应的沉淀是:Fe(OH)3和BaSO4
C.OA段可能发生的反应是:3Ba2++ 60H-+ 3S042-+ Al3++Fe3+=3BaSO4+_Fe(OH)3+Al(OH)3
D.据图计算原溶液中:c(Cl-) =c(SO42-)
难度: 极难查看答案及解析
-
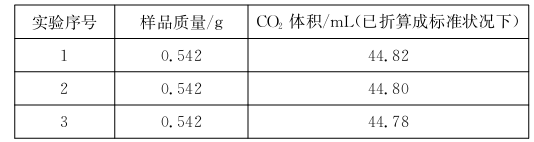
将11.2 g铜粉和镁粉的混合物分成两等份,其中一份加入200 mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2. 24 L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3) =2 mol.L-l ②(( HNO3)=0.5 mol.L-1 ③m=8.0④m=7.2。其中正确的是
A.①④ B.①③ C.②④ D.②③
难度: 困难查看答案及解析