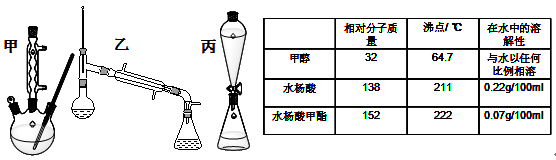
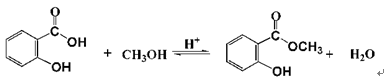
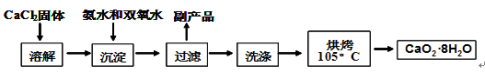
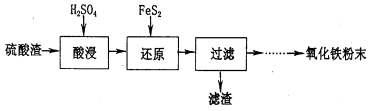
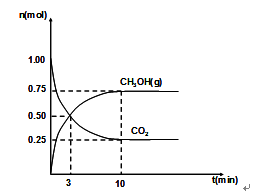
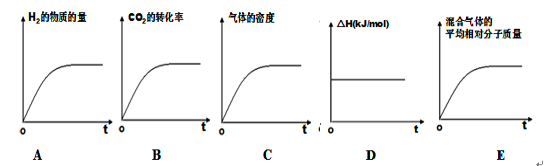
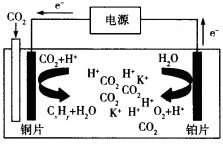
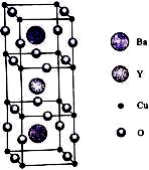
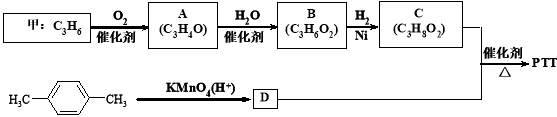
-
NA表示阿伏加德罗常数的值,常温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是

A.反应前气体的总体积为1.344L
B.装置中产生大量的白色烟雾
C.反应前后分子总数不变,均为0.06 NA个
D.生成物充分溶于水后所得溶液含有0.01 NA个NH4+
难度: 中等查看答案及解析
-
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是
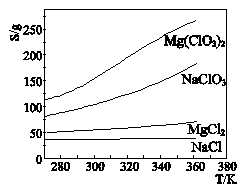
A.将NaClO3溶液蒸干灼烧可得NaCl固体
B.将Mg(ClO3)2溶液蒸干灼烧可得MgCl2固体
C.一定条件下MgCl2和NaClO3可发生复分解反应生成Mg(ClO3)2
D.NaClO3中混有少量MgCl2杂质,可用重结晶法提纯
难度: 中等查看答案及解析
-
下列实验能达到预期目的是
选项
实验内容
实验目的
A.
测同温同浓度下的Na2CO3和Na2SO3水溶液的pH
确定碳和硫两元素非金属性强弱
B.
取一定质量的铝片,与过量的NaOH溶液充分反应,溢出的气体通过硅胶后,测其体积
确定铝片中氧化铝的含量
C.
取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液
证明Na2SO3部分被氧化
D.
向CH2=CHCH2OH中滴加酸性KMnO4溶液
证明CH2=CHCH2OH中含有碳碳双键
难度: 中等查看答案及解析
-
同分异构体数目与C6H14相同的化合物是
A.C4H8 B.C4H9Cl C.C4H10O D.C4H8O2
难度: 困难查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A.
铝制餐具不宜长时间存放酸性、碱性和咸的食物
铝能与食物中的酸、碱和盐反应
B.
伤口消毒常应用75%的酒精而不是95%
75%的酒精其氧化性要强于95%
C.
工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+等金属离子
Ksp(MnS)>Ksp(CdS)
D.
洁厕灵不能与“84”消毒液混用
两种溶液混合产生的HClO易分解
难度: 简单查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
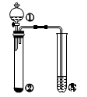
A.
稀盐酸
Na2S
漂粉精溶液
酸性:盐酸>氢硫酸>次氯酸
B.
浓盐酸
KMnO4
Na2S溶液
氧化性:KMnO4> Cl2>S
C.
浓氨水
NaOH
酚酞
碱性:NaOH >NH3·H2O
D.
浓硫酸
Na2SO3
BaCl2溶液
SO2与可溶性钡盐均不反应
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的气态氢化物与其最高级氧化物对应的水化物能反应生成一种盐,Y原子的最外层电子数与其电子层数相等,Z、W与Y同周期且互不相邻。下列叙述正确的是
A.X的单质与氧气反应可生成六种氧化物
B.Z位于第3周期第ⅥA族
C.对应单质熔点:Z >Y > W
D.对应原子半径:Z > W > X
难度: 中等查看答案及解析